В рамках VII Московской Урологической Школы 21 сентября состоялась пресс-конференция члена-корреспондента РАН, главного уролога Министерства здравоохранения РФ Дмитрия Пушкаря и радиолога Валерия Крылова. Встреча была посвящена инновационным методам лечения рака предстательной железы.
Дмитрий Пушкарь, заведующий кафедрой урологии МГМСУ, руководитель клиники урологии на базе Городской клинической больницы им. С.И. Спасокукоцкого начал пресс-конференцию с развенчания мифов о раке простаты. По его словам, неверно и опасно полагать, что рак простаты у всех мужчин, что его можно не лечить и что у конкретного человека его никогда не будет. Это все заблуждения, из-за которых пациенты не начинают вовремя лечение. Член-корреспондент РАН назвал и причины появления рака:
«Мы знаем, что избыточное употребление животных жиров способствует развитию всех онкологических заболеваний. Гиподинамия, высокий сахар, высокое давление способствуют развитию вообще всех заболеваний».
Он также привел статистику: 50% больных в России – это больные с распространенными формами рака простаты. Даже после проведения операции не может быть гарантии, что в организме пациента больше нет микропоражений в костях и лимфоузлах. До недавних пор обнаружить их не представлялось возможным.
Заведующий отделением радиохирургического лечения открытыми радионуклидами Медицинского радиологического научного центра им. А.Ф. Цыба Валерий Крылов подтвердил, что ранее не существовало методов визуализировать распространившиеся по организму единичные раковые клетки. Теперь эти клетки можно не только обнаружить, но и уничтожить. Валерий Крылов рассказал о таком методе — радионуклидной терапии на примере рака щитовидной железы:
«Большая часть пациентов, с которыми мы работаем в ядерной медицине, – больные раком щитовидной железы. Раковые клетки метастазировали и разбежались по всему организму, их не найдешь и не достанешь. Нет, достанешь! С помощью радиоактивного йода, который избирательно в этой клетке накапливается. Мы можем, во-первых, увидеть ее. Во-вторых, убить. Это естественный природный таргетинг».
Радиолог рассказал о механизме действия: на поверхности раковой клетки есть белковые отростки, к ним можно «приставить» радиоактивный заряд, который докажет наличие раковых клеток, и, заменив диагностический заряд на терапевтический, их можно убить. Этот терапевтический заряд – радиофармацевтический препарат, содержащий лечебный радионуклид. Такая терапия, по словам Валерия Крылова, обладает высокой селективностью при минимальном повреждении кроветворных клеток.
Этот вид терапии не может гарантировать полного излечения, однако, как сказал заведующий отделением радиохирургического лечения открытыми радионуклидами, она поможет больным перестать испытывать боль:
«Мы можем избавить пациента от страданий, продлить жизнь и сделать ее более счастливой. Он будет либо каждый день проживать в муках, в пытках, либо жить, так скажем, на свободе и без боли. Ради этого стоит делать эту терапию».
Дмитрий Пушкарь затронул и вопросы диагностики рака простаты. Он признался, что выступает за скрининг и против ранней диагностики. Член-корреспондент РАН рассказал, что несколько лет назад появились научные работы, в которых исследователи, после наблюдения за пациентами, пришли к выводу, что есть такие виды рака простаты, которые можно не лечить. По мнению Дмитрия Пушкаря, делать такие заявления опасно:
«Сказать такое в России – преступление. У нас есть пословица – «Слышу звон, не знаю, где он». Люди, которые услышали, что рак можно не лечить у 2% больных, решили, что его вообще не нужно лечить».
Оба спикера пришли к мнению, что клинические и радионуклидные специалисты, онкоурологи, урологи, хирурги, онкологи должны работать вместе и сообща, перенимая опыт друг друга. В медицинских вузах будущие урологи должны изучать и онкологию, и радиологию.
На сегодняшний день рак простаты находится на втором месте в структуре онкологической заболеваемости у мужчин в России и на третьем – в структуре смертности. Сейчас эта болезнь поддается лечению, однако она может прогрессировать и угрожать жизни.
Источник scientificrussia.ru
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.

Читайте в новом номере
В настоящее время в России и во многих других странах наметилась стойкая тенденция к увеличению числа больных раком простаты. Популяризация знаний об этом заболевании и современные возможности ранней диагностики позволили значительно увеличить выявляемость рака простаты на ранних стадиях, когда лечение может быть максимально эффективным.
При подробном анализе распространенности РПЖ в России выясняется, что почти у половины больных заболевание впервые выявляется на 3–4 стадии, что значительно затрудняет лечение и снижает его эффективность.
Столь широкое распространение РПЖ ставит его в ряд наиболее важных социальных проблем современности. Болезнь исключительно редко развивается раньше 40 лет и становится все более частым явлением с каждым последующим десятилетием жизни. По данным американских источников, никак себя не проявляющие очаги злокачественного перерождения предстательной железы выявляются у 15–30% мужчин старше 50 лет и у 80% мужчин старше 80 лет. Известно, что при наличии РПЖ у кровного родственника риск заболеть повышается в 2–3 раза.
Как и рак молочных желез у женщин, это заболевание на ранних стадиях практически всегда является случайной находкой или результатом специализированного скринингового обследования, поскольку длительное время не имеет никаких специфичных клинических проявлений, маскируясь за симптомами расстройства мочеиспускания, характерными для аденомы простаты, а иногда вовсе не причиняя пациенту никакого беспокойства.
Причины развития рака простаты точно не установлены, как и для большинства злокачественных опухолей. Тем не менее доказаны некоторые факторы риска возникновения рака простаты. К ним относятся возраст, расовая принадлежность, наследственность. Наследственно обусловленный РПЖ нередко манифестирует у мужчин моложе 55 лет и имеет более агрессивное течение. Так как клинически значимый РПЖ чаще поражает мужчин в возрасте от 45 до 65 лет и именно у них он протекает более агрессивно и злокачественно, этой категории пациентов показано обязательное ежегодное скрининговое (профилактическое) обследование. Обязательные элементы этого осмотра приведены ниже в разделе «Диагностика».
Факторы окружающей среды, особенно различия в диете также играют важную роль в развитии рака простаты. Высокий уровень содержания в пище жиров животного происхождения является доказанным отрицательным фактором прогноза. В то же время было доказано, что азиатская диета, богатая соей, морепродуктами, рисом, грибами шиитаке, рыбой и зеленым чаем, оказывает некоторый защитный эффект и предотвращает развитие РПЖ.
Как было сказано выше, на начальной стадии РПЖ не имеет выраженной клинической симптоматики, что существенно затрудняет его диагностику. Признаки нарушения оттока мочи одновременно из обеих почек с развитием почечной недостаточности или появление болей в костях могут свидетельствовать о распространенности процесса.
Обнаружение простатоспецифического антигена (ПСА) в 1980-е гг. привело к революции в ранней диагностике РПЖ. ПСА – это белок, который выделяется предстательной железой и может определяться в крови в различных концентрациях. Условной границей нормы считается 4 нг/мл, но многие ведущие урологические клиники мира в последние годы склонны снижать норму этого показателя до 2,5 нг/мл, вводя дополнительные понижающие коэффициенты для более молодых мужчин. Тревожным может являться не только высокое абсолютное значение ПСА, но и высокие темпы его годового прироста (более 0,75 нг/мл). Повышение уровня ПСА – не всегда доказательство наличия рака простаты. Чувствительность этого онкомаркера составляет более 95%, а специфичность – около 75%. То есть в 25% случаев повышение уровня ПСА связано с другими причинами: наличием аденомы простаты, хроническим воспалением в предстательной железе и т. д. Так, уровень сывороточного ПСА может увеличиваться при различных манипуляциях с предстательной железой (массаж, биопсия), даже после эякуляции накануне исследования, а также при наличии инфекции.
«Золотой стандарт» диагностики рака простаты – комбинация пальцевого ректального исследования (ПРИ) (рис. 1) и анализа крови на содержание ПСА. При выявлении изменений того или иного показателя выполняется мультифокальная биопсия под контролем УЗИ. Это непродолжительная безболезненная манипуляция, в ходе которой специальным автоматическим устройством, введенным с ультразвуковым датчиком в прямую кишку, выполняется забор нескольких фрагментов ткани для гистологического исследования (рис. 2). Обычно она проводится амбулаторно (не требует госпитализации) и подразумевает выполнение 12 биопсийных вколов. В отдельных случаях (большой объем простаты, повторная биопсия и т. д.) биопсия может выполняться из большего количества точек.
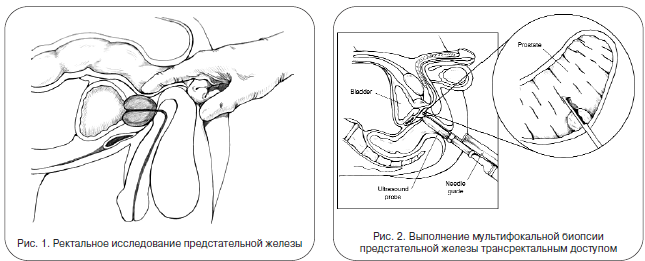
После получения данных гистологического исследования определяется характеристика опухоли, иначе говоря, степень ее злокачественности. От нее зависят прогноз течения заболевания и выбор тактики лечения. Значение имеют и локализация опухоли в предстательной железе, и процент опухолевой ткани в биоптате, и подтверждение поражения семенных пузырьков, и, конечно, прорастание опухоли за границу предстательной железы. Гистологическая градация осуществляется по шкале Глисона. Чем больше сумма Глисона, тем хуже прогноз. Также в диагностике РПЖ применяются сканирование костей скелета (это позволяет исключить наличие метастазов в костях – «излюбленном» месте метастазирования РПЖ), магнитно-резонансная томография с контрастированием (дает дополнительную информацию о локализации опухоли в простате и возможном распространении опухоли за капсулу простаты, а также о состоянии регионарных лимфатических узлов). Компьютерная томография и УЗИ имеют ограниченную ценность в диагностике РПЖ. Конечной задачей обследования является определение стадии заболевания. С помощью существующих в настоящее время методов диагностики верно установить стадию РПЖ затруднительно. Лишь совокупность всех данных обследования позволяет с высокой вероятностью точно стадировать опухоль и дать прогноз.
Широкое внедрение программ скрининга рака простаты, основанных на ПРИ и определении уровня ПСА, привело к увеличению числа случаев выявления «локализованного» РПЖ, причем задолго до его клинических проявлений (опухоль, ограниченная капсулой простаты и не распространяющаяся за ее пределы).
На сегодняшний день существуют различные методы лечения этой формы заболевания, такие как динамическое наблюдение, радикальная простатэктомия, дистанционная лучевая терапия, брахитерапия (внедрение в ткань простаты радиоактивных зерен), криохирургия («замораживание» ткани простаты при помощи специальных методик), применение высокоинтенсивного сфокусированного ультразвука (HIFU – методика «нагревания ткани простаты»).
Выбор тактики зависит от возраста больного, сопутствующих заболеваний, клинической стадии болезни, распространения опухоли и ее гистологических характеристик. Очень важно составить прогноз течения заболевания, что возможно на основании накопленного во всем мире многолетнего опыта наблюдения и лечения больных раком простаты. Хотя диагноз РПЖ на сегодняшний день ставится довольно часто, известно, что только у 25% больных непосредственной причиной смерти будет являться это заболевание.
Возраст больного – один из ключевых показателей при выборе оптимальной тактики лечения. Так, 75% больных младше 65 лет умирают от РПЖ при отсутствии надлежащего лечения. Также было установлено, что 50% пациентов с локализованным высокодифференцированным РПЖ живут более 15 лет от момента установления диагноза, даже если активного лечения не проводится.
Подход к лечению больных РПЖ должен быть сугубо индивидуальным. Максимально радикальное лечение – хирургическое (радикальная простатэктомия) подразумевает полное удаление простаты без вскрытия ее фасции единым блоком с семенными пузырьками. Если эта операция выполнена вовремя, с соблюдением всех онкологических принципов и по показаниям, то она позволяет полностью избавить больного от злокачественной опухоли и обеспечивает хороший прогноз для жизни.
Существует несколько методик выполнения операции: открытое вмешательство, в ходе которого радикальная простатэктомия осуществляется из разреза в надлонной области; роботическая простатэктомия, при которой используется высокотехнологичный роботический комплекс «Да Винчи»; лапароскопическое вмешательство.
Независимо от выбранной методики идея операции остается неизменной – выделение простаты без повреждения капсулы, отсечение ее от мочевого пузыря и мочеиспускательного канала и наложение соустья между пузырем и мочеиспускательным каналом. При необходимости выполняется удаление регионарных лимфатических узлов. Такая операция может быть рекомендована относительно молодым больным с ожидаемой продолжительностью жизни не менее 10–15 лет без тяжелых сопутствующих заболеваний. Несмотря на сопоставимые онкологические результаты, темпы восстановления после операции, сроки медицинской и социальной реабилитации больных во многом зависят именно от выбранной оперативной методики.
Несмотря на хорошие результаты радикальной операции, как и любое другое хирургическое вмешательство, она имеет ряд осложнений, наиболее характерными из которых являются недержание мочи и эректильная дисфункция. Частота осложнений меньше ассоциирована с методикой выполнения операции, но определенно зависит от опыта хирурга и индивидуальных особенностей пациента. Несомненно, существуют способы борьбы с подобными осложнениями, но лучше проводить профилактику их возникновения. Основополагающим ее элементом является определение показаний к операции. Второй по значимости фактор – соблюдение техники выполнения операции, имеющей много тонкостей и особенностей. Так, в зависимости от стадии процесса, локализации опухоли в простате и исходного уровня сексуальной активности у части больных операция может быть выполнена с сохранением нервов, ответственных за эректильную функцию.
Гормональная и химиотерапия в настоящее время большинством экспертов не одобрены для лечения локализованного рака простаты и должны быть резервированы для пациентов с распространенным онкологическим поражением. В таких случаях хороший результат может дать сочетанное лечение – комбинация медикаментозной и дистанционной лучевой терапии. Известно, что лучевая терапия уже десятилетия используется для лечения онкологических заболеваний. За счет поражающего радиоактивного излучения опухолевые клетки теряют свою репродуктивную активность. Радиоактивное излучение проникает глубоко в ткани. Обычно подбирается индивидуальная доза облучения – в зависимости от клинической стадии болезни. Гормональная терапия – один из стандартов нехирургического лечения распространенного РПЖ. Простата – гормоночувствительный орган, биохимические процессы в котором зависят от уровня тестостерона. Устранение его влияния на ткань простаты позволяет добиться гибели гормоночувствительных клеток, присутствующих в раковой опухоли.
Наряду с дистанционным лучевым воздействием в лечении локализованного РПЖ используется интерстициальная лучевая терапия, или брахитерапия. Источники излучения, введенные непосредственно в опухоль, обеспечивают более локальное воздействие. Опыт подобного лечения в отдельных странах насчитывает более 20 лет. Она применима у пациентов с относительно небольшими размерами простаты и невысокими значениями ПСА и обеспечивает хорошие результаты лечения.
Криотерапия представляет собой аблацию ткани путем локального воздействия очень низкой температуры и также показана пациентам с локализованным РПЖ. В 1996 г. Американская ассоциация урологов признала криоаблацию предстательной железы методом терапии локализованного РПЖ и перестала считать данную методику экспериментальной. В настоящее время криоаблация простаты представляет собой минимально инвазивный высокоэффективный способ лечения РПЖ. Посредством введения в простату 12–20 криоигл можно добиться локального снижения температуры тканей ниже 40°С. При этой температуре целостность клеток нарушается, и опухоль разрушается. В дальнейшем на этом месте происходит процесс рубцевания. Ограничения при выборе пациентов для криоаблации простаты сравнимы с таковыми при брахитерапии – большой объем простаты и выход опухоли за границы простаты. Неоспоримые преимущества криоаблации и брахитерапии – малая травматичность операции, низкий процент осложнений и меньшее количество ограничений в связи с возрастом и общим терапевтическим статусом пациента.
Высокоинтенсивный сфокусированный ультразвук, также относящийся к малотравматичным методам лечения, пока не одобрен мировой урологической общественностью ввиду малой продолжительности наблюдений и остается экспериментальным методом лечения РПЖ.
Важно помнить, что вопрос принятия решения о тактике лечения во многом зависит от выбора самого пациента и является результатом подробной беседы со специалистом, включающей тщательный анализ преимуществ и рисков того или иного метода лечения.
В этой статье мы не преследовали цель дать исчерпывающие знания о принципах диагностики и лечения рака простаты – проблемы сложной и многогранной. Мы лишь пытались создать представление о современных возможностях лечения этого грозного заболевания. Рак простаты хорошо поддается лечению и давно перестал быть приговором.
Источник www.rmj.ru
Для цитирования: Пушкарь Д.Ю., Раснер П.И. Рак предстательной железы. Библиотека пациента. Урология // РМЖ. 2013. №18. С. 2
Рак предстательной железы (РПЖ) – одно из наиболее часто встречающихся злокачественных новообразований у мужчин среднего и пожилого возраста. За период с конца 1970-х до начала 1990-х гг. частота раковых заболеваний предстательной железы почти удвоилась. В структуре онкологических заболеваний в ряде стран РПЖ выходит на 2–3-е место после рака легких и желудка, а в США и Швеции – на 1-е место. В США и Европе суммарно регистрируется около 450 тыс. новых случаев заболеваний в год. При подробном анализе распространенности РПЖ в России выясняется, что почти у половины больных заболевание впервые выявляется на III–IV стадии, что значительно затрудняет лечение и снижает его эффективность.
Столь широкое распространение РПЖ ставит его в ряд наиболее важных социальных проблем современности. Болезнь исключительно редко развивается раньше 40 лет и становится все более частым явлением с каждым последующим десятилетием жизни. По данным США, никак себя не проявляющие очаги злокачественного перерождения предстательной железы выявляются у 15–30% мужчин старше 50 лет и у 80% мужчин старше 80 лет. Известно, что при наличии РПЖ у кровного родственника риск заболеть повышается в 2-3 раза.
Как и рак груди у женщин, это заболевание на ранних стадиях практически всегда является случайной находкой или результатом специализированного скринингового обследования, поскольку длительное время не имеет никаких специфических клинических проявлений, маскируясь под симптомы расстройства мочеиспускания, характерныме для аденомы простаты, а иногда вовсе не причиняя больному никакого беспокойства.
Причины развития рака простаты точно не установлены, как и для большинства раков. Тем не менее для простаты доказаны некоторые факторы риска, такие как возраст, расовая принадлежность, наследственность. Наследственно обусловленный РПЖ нередко манифестирует у мужчин моложе 55 лет и имеет более агрессивное течение. Так как клинически значимый РПЖ чаще поражает молодых мужчин в возрасте от 45 до 65 лет, и именно у них он протекает более злокачественно, эти пациенты являются кандидатами для обязательного ежегодного скринингового осмотра (профилактического обследования). Обязательные элементы этого осмотра приведены ниже.
Факторы окружающей среды, особенно различия в диете, также играют важную роль в развитии рака простаты. Высокое содержание в пище жиров животного происхождения является доказанным отрицательным фактором прогноза. В то же время было доказано, что азиатская диета, богатая соей, морепродуктами, рисом, грибами шиитаке, рыбой и зеленым чаем, оказывает некоторый защитный эффект и предотвращает развитие РПЖ.
Диагностика
Как было сказано выше, на начальной стадии РПЖ не имеет выраженной клинической симптоматики, что существенно затрудняет его диагностику. Признаки нарушения оттока мочи одновременно из обеих почек с развитием почечной недостаточности или появление болей в костях могут свидетельствовать о распространенности процесса.
Появление простат-специфического антигена (ПСА) в 1980-е гг. привело к революции в ранней диагностике РПЖ. ПСА – это белок, который выделяется предстательной железой и может определяться в крови в различных концентрациях. Условной границей нормы считается 4 нг/мл, но многие ведущие урологические клиники мира последние годы склонны снижать норму этого показателя до 2,5 нг/мл, вводя дополнительные понижающие коэффициенты для более молодых мужчин.
Тревогу должно вызвать не только высокое абсолютное значение ПСА, но и высокие темпы его годового прироста (более 0,75 нг/мл). Повышение уровня ПСА – не всегда доказательство наличия рака простаты. Чувствительность этого онкомаркера – более 95%, а специфичность составляет около 75%, т.е. в 25% случаев повышение ПСА связано с другими причинами – наличием аденомы простаты, хроническим воспалением в предстательной железе и т.д. Так, уровень сывороточного ПСА может увеличиваться при различных манипуляциях с предстательной железой, такими как массаж, биопсия, инфекции, и даже после эякуляции накануне исследования.
«Золотой стандарт» диагностики рака простаты – комбинация пальцевого ректального исследования и анализа крови на содержание ПСА (рис. 1). При выявлении изменений того или иного показателя выполняется мультифокальная биопсия под контролем ультразвукового исследования (рис. 2). Это непродолжительная безболезненная манипуляция, в ходе которой специальным автоматическим устройством, введенным с ультразвуковым датчиком в прямую кишку, выполняется забор нескольких фрагментов ткани для гистологического исследования. Обычно она проводится амбулаторно (не требует госпитализации) и подразумевает выполнение 12 биопсийных вколов. В отдельных случаях (большой объем простаты, повторная биопсия и т.д.) может проводиться биопсия из большего количества точек.
После получения данных гистологического исследования определяется характеристика опухоли, иначе говоря, степень ее злокачественности. От нее зависят прогноз течения заболевания и выбор тактики лечения. Значение имеют и локализация опухоли в предстательной железе, и процент опухолевой ткани в биоптате, и поражение семенных пузырьков, и, конечно, прорастание опухоли за границу предстательной железы. Гистологическая градация осуществляется по шкале Глисона. Чем выше сумма Глисона, тем хуже прогноз.
Также в диагностике РПЖ применяются сканирование костей скелета (позволяет исключить наличие костных метастазов) – излюбленного места метастазирования РПЖ, магнитно-резонансная томография с контрастированием (МРТ) – дает дополнительную информацию о локализации опухоли в простате и возможном распространении опухоли за капсулу простаты, а также о состоянии регионарных лимфатических узлов. Компьютерная томография и ультразвуковое исследование имеют ограниченную ценность в диагностике РПЖ. Конечной задачей обследования является установка стадии заболевания. Ни один из методов диагностики, существующих в настоящее время, не способен сам по себе точно определить стадию РПЖ. Лишь совокупность всех данных позволяет с высокой вероятностью стадировать опухоль и сделать прогноз течения заболевания.
Лечение
Широкое внедрение программ скрининга рака простаты, основанное на пальцевом ректальном исследовании и определении ПСА, привело к увеличению числа случаев выявления «локализованного РПЖ», причем задолго до его клинических проявлений (опухоль, ограниченная капсулой простаты и не распространяющаяся за ее пределы). На сегодняшний день существуют различные методы лечения этой формы заболевания, такие как динамическое наблюдение, радикальная простатэктомия, дистанционная лучевая терапия, брахитерапия (внедрение в ткань простаты радиоактивных зерен), криохирургия («замораживание» ткани простаты при помощи специальных методик), высокоинтенсивный сфокусированный ультразвук (HIFU – методика «нагревания ткани простаты»).
Выбор тактики зависит от возраста больного, сопутствующих заболеваний, клинической стадии болезни, распространения опухоли и ее гистологических характеристик. Очень важно составить прогноз течения заболевания, что возможно на основании накопленного во всем мире многолетнего опыта наблюдения и лечения больных раком простаты. Хотя диагноз РПЖ на сегодняшний день выставляется довольно часто, известно, что только у 25% больных непосредственной причиной смерти будет являться это заболевание.
Возраст больного – один из ключевых показателей при выборе оптимальной тактики лечения. Так, 75% больных младше 65 лет умирают от РПЖ при отсутствии надлежащего лечения. Также установлено, что 50% пациентов с локализованным высокодифференцированным РПЖ живут более 15 лет от момента установления диагноза, даже если активного лечения не проводится.
Подход к лечению больных РПЖ должен быть сугубо индивидуальным. Максимально радикальное лечение – хирургическое (радикальная простатэктомия) – подразумевает полное удаление простаты без вскрытия ее фасции единым блоком с семенными пузырьками. Если эта операция выполнена вовремя, с соблюдением всех онкологических принципов и по показаниям, то она позволяет полностью избавить больного от злокачественной опухоли и обеспечивает хороший прогноз для жизни.
Существует несколько методик выполнения операции: открытое вмешательство, в ходе которого радикальная простатэктомия осуществляется из разреза в надлонной области, роботическая простатэктомия, при которой используется высокотехнологичный роботический комплекс «Да Винчи», лапароскопическое вмешательство. Независимо от выбранной методики идея операции остается неизменной – выделение простаты без повреждения капсулы, отсечение ее от мочевого пузыря и мочеиспускательного канала и наложение соустья между пузырем и мочеиспускательным каналом. При необходимости выполняется удаление регионарных лимфатических узлов. Такая операция может быть рекомендована относительно молодым больным с ожидаемой продолжительностью жизни не менее 10–15 лет без тяжелых сопутствующих заболеваний. Несмотря на сопоставимые онкологические результаты, темпы восстановления после операции, сроки медицинской и социальной реабилитации больных во многом зависят именно от выбранной оперативной методики.
Радикальная операция, как и любое другое хирургическое вмешательство, имеет ряд осложнений, наиболее характерными из которых являются недержание мочи и эректильная дисфункция. Частота осложнений меньше ассоциирована с методикой выполнения операции, но определенно зависит от опыта хирурга и индивидуальных особенностей пациента. Несомненно, даже при развитии подобных осложнений существуют способы борьбы с ними, но оптимальным является профилактика их возникновения. Основополагающий элемент – определение показаний к операции, принципы которых описаны выше.
Второй по значимости фактор – соблюдение техники операции, имеющей много тонкостей и особенностей. Так, в зависимости от стадии процесса, локализации опухоли в простате и исходного уровня сексуальной активности у части больных операция может быть выполнена с сохранением нервов, ответственных за эректильную функцию.
Гормональная и химиотерапия в настоящее время большинством экспертов не одобрена для лечения локализованного рака простаты и должна быть зарезервирована для пациентов с распространенным онкологическим поражением. В таких случаях хороший результат может дать сочетанное лечение – комбинация медикаментозной и дистанционной лучевой терапии.
Известно, что лучевая терапия уже десятилетия используется для лечения онкологических заболеваний. За счет поражающего радиоактивного излучения опухолевые клетки теряют свою репродуктивную активность. Радиоактивное излучение проникает глубоко в ткани. Обычно подбирается индивидуальная доза облучения в зависимости от клинической стадии болезни.
Гормональная терапия – один из стандартов нехирургического лечения распространенного РПЖ. Простата – гормонально чувствительный орган, биохимические процессы в котором зависят от уровня тестостерона. Устранение влияния тестостерона на ткань простаты позволяет добиться гибели гормоночувствительных клеток, присутствующих в раковой опухоли.
Наряду с дистанционным лучевым воздействием в лечении локализованного РПЖ используется интерстициальная лучевая терапия или брахитерапия. Источники излучения, введенные непосредственно в опухоль, обеспечивают более локальное воздействие. Опыт подобного лечения в отдельных странах насчитывает более 20 лет. Брахитерапия применима у пациентов с относительно небольшими размерами простаты и невысокими значениями ПСА и обеспечивает хорошие результаты лечения.
Криотерапия представляет собой аблацию ткани путем локального воздействия очень низкой температуры и также показана пациентам с локализованным РПЖ. В 1996 г. Американская ассоциация урологов признала криоаблацию предстательной железы методом терапии локализованного РПЖ и перестала считать данную методику экспериментальной. В настоящее время криоаблация простаты представляет собой минимально инвазивный, высокоэффективный способ лечения РПЖ. Техника ее выполнения позволяет посредством введения в простату 12–20 криоигл добиться локального снижения температуры тканей ниже 40°С. При этой температуре целостность клеток нарушается, и опухоль разрушается. В дальнейшем на этом месте происходит процесс рубцевания.
Ограничения при выборе пациентов для криоаблации простаты похожи на таковые при брахитерапии – большой объем простаты и выход опухоли за границы простаты. Неоспоримыми преимуществами криаблации и брахитерапии являются малая травматичность операции, низкий процент осложнений и меньшее количество ограничений по возрасту и общему терапевтическому статусу пациента.
Высокоинтенсивный сфокусированный ультразвук, также относящийся к малотравматичным методам лечения, пока не одобрен мировой урологической общественностью ввиду малой продолжительности наблюдений и остается экспериментальным методом лечения РПЖ.
Важно помнить, что вопрос принятия решения о тактике лечения во многом зависит от выбора самого пациента и является результатом подробной беседы со специалистом, включающей тщательный анализ преимуществ и рисков того или иного метода лечения. В этой статье мы не преследовали цель дать исчерпывающие знания о принципах диагностики и лечения рака простаты – проблемы, которая является сложной и многогранной. Мы лишь пытались убедить в наличии современных возможностей лечения этого грозного заболевания. Рак простаты давно перестал быть приговором и является заболеванием, которое можно и должно лечить, добиваясь хороших результатов и продлевая пациентам жизнь зачастую на долгие-долгие годы.
Источник medblog.su