Болезнь не щадит никого, рак является одной из самых тяжелых. Если вовремя не обратиться к врачу, то могут возникнуть большие проблемы. Тогда только медикаментами тут уже не обойтись. Придется прибегнуть к кардинальным действиям, к которым относится лучевая терапия. При раке предстательной железы последствия ее непредсказуемые. Об этом мы сейчас и поговорим, но сначала…

Что такое лучевая терапия
Это эффективное и целесообразное лечение при онкологических патологиях, к которым относится и рак простаты. Основана она на ионизирующей радиации, действует целенаправленно, уничтожает только больные клетки, здоровые не подвергаются ее воздействию.
- Излучение ионов направляется туда, где находятся молекулы, содержащие воду и клетки опухоли.
- После попадания луча в них появляются пероксид водорода и свободные радикалы.
- Полученные продукты блокируют работу больных клеток, их рост и размножение.
Лечение рака предстательной железы лучевой терапией основывается еще и на том, что активность радикалов и пероксида водорода зависит от обмена веществ. Чем он выше, тем опухоль питается активнее, что, в свою очередь, ведет к увеличению пагубного воздействия на нее радиации.
Данный способ лечения применяется на всех стадиях развития болезни, независимо от области поражения органа и распространения метастазов. Кроме этого, эффективно используется лучевая терапия после удаления рака предстательной железы как профилактическое и лечебное средство.

Излучение, направленное на раковые клетки, делится на два типа:
- волновое – основано на гамма-излучении и рентгеновских лучах;
- корпускулярный метод – это протонная терапия, включающая в себя: электронное излучение, альфа- и бета-частицы, нейтронное и протонное излучение.
Существует три способа воздействия лучевой терапии на злокачественную опухоль:
- дистанционный;
- контактный;
- интерстициальный.
Разновидности процедуры
В настоящее время несколько разновидностей имеет лучевая терапия при раке предстательной железы, последствия и эффективность лечения зависят от формы заболевания:
- Конформная. Применяется в том случае, если возникает необходимость полного и равномерного облучения болезнетворной опухоли. Создается 3D-изображение образования. При этом учитываются все ткани и органы, находящиеся рядом. Ионы радиации влияют лишь на раковые клетки, неповрежденные органы и ткани остаются нетронутыми.
- С модулированной интенсивностью. Луч, который направляется на опухоль, разделяется на несколько более мелких. Сила каждого из лучевых потоков программируется. В связи с этим здоровые участки простаты получают малую дозу радиации, в то время как на болезнетворные клетки оказывается основное воздействие.
- Протонная. Специалисты считают, что этот способ самый эффективный при раке предстательной железы. Протоны воздействуют только на больные клетки, но не при всех формах рака данную процедуру назначают.
- Нейтронная. Используется в том случае, если другие методы не помогли.
Дистанционное облучение
Особенности данного вида облучения заключаются в том, что во время сеанса оказывается губительное воздействие не только на больные клетки, но и на здоровые. Для процедуры используется специальный аппарат, он помогает регулировать длину волн, что способствует максимально возможному снижению действия лучей на здоровую область.
Это оборудование высокоточное, и работать с ним может только специалист, прошедший подготовку. Если аппарат используется неправильно, пациент может не улучшить свое состояние, а, наоборот, ухудшить его.
Сначала проводится обследование, после чего строится объемное расположение опухоли, а затем врач старается направить радиоволны на нее.
Дистанционная лучевая терапия рака предстательной железы проводится каждый день или согласно графика, составленного лечащим врачом на протяжении семи-восьми недель.
Дистанционная терапия, в свою очередь, делится на два вида: неподвижный и мобильный.
Первый вид заключается в следующем:
- Больного располагают в одной конкретной позиции.
- Направляют на него источник излучения (он тоже стационарен).
Второй вид, мобильный:
- Передвигают источник излучения.
- Направляют его на опухоль простаты, аппарат передвигается вокруг пациента и действует на раковые клетки со всех сторон.
Иногда при использовании такого способа требуется небольшой перерыв в лечении.
Интерстициальный метод (брахитерапия)
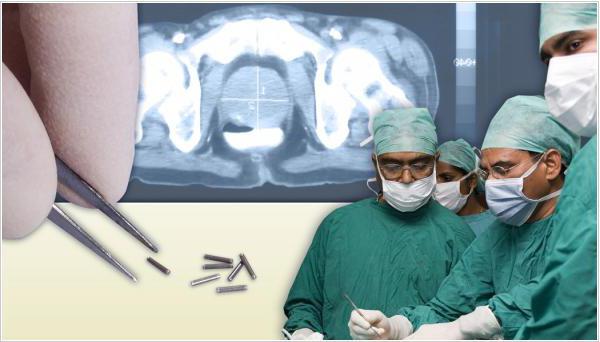
Эффективное средство лечения рака — это брахитерапия. Наибольший успех данный метод имеет, если опухоль находится в пределах предстательной железы. Суть его заключается в следующем: при помощи специальной иглы внутрь опухоли вводится радиоактивное вещество. В качестве вещества используется йод -125 . Процедура проходит под контролем УЗИ.
В зависимости от того, как расположены капсулы, содержащие радиоактивное вещество, брахитерапия делится на:
- внутриполостную;
- внутритканевую;
- внутрисосудистую.

После процедуры пациент находится в стационаре сутки. Облегчение наступает через несколько дней. Радиоактивное вещество распадается в организме на протяжении двух месяцев. За это время раковые клетки погибают.
Главный плюс брахитерапии – радиация оказывает воздействие только на поврежденные клетки, здоровые остаются нетронутыми. Вот поэтому после данной процедуры развивается меньше осложнений, чем после дистанционного облучения.
Протонный метод и адъювантная терапия
Это один из неинвазивных видов лучевой терапии, помогающий избавиться от рака предстательной железы. Основывается этот способ на точнейшем действии радиации на патогенную точку, образовавшуюся в железе. Благодаря тому что доза распределяется точно, все формы раковых заболеваний полностью излечиваются. Побочных осложнений нет.
Следующий способ – это адъювантная лучевая терапия при раке предстательной железы. Используется как:
- профилактика;
- вспомогательное средство;
- средство, дополняющее хирургическое вмешательство.
Цель этой терапии – разрушение вторичной опухоли.
Этот способ оказывает влияние на распространение раковых клеток и их рост. Энергия мощного излучения способна убить больные клетки, которые остались после операции. Таким способом повышается эффективность лечения. В зависимости от желаемой цели, используется внутреннее или внешнее излучение. Оно направляется на место образования опухоли, снижается риск повторения онкологии в этой области.
Паллиативная лучевая терапия
Чаще всего используется такая лучевая терапия при раке предстательной железы. Последствия болезни в этом случае достигают четвертой стадии. Паллиативный вид направлен на облегчение состояния пациента. Наружная лучевая терапия способствует уменьшению опухоли и боли и предполагает проведение следующих мероприятий:
- Чтобы снять симптомы недуга, проводится хирургическое вмешательство, трансуретральная резекция простаты. Благодаря паллиативному лечению удается уменьшить развитие болезни.
- Назначается такой вид лучевой терапии в комплексе с гормональными препаратами на последней стадии рака предстательной железы. Это мероприятие снижает болевой синдром, устраняет побочные влияния раковых клеток.
- При обнаружении местнораспространенного рака простаты используется методика ультразвуковой абляции, которая тоже относится к паллиативной терапии. Она помогает устранить побочные эффекты болезни.
Последствия лучевой терапии
Хотя внедрение новых методик способно снизить негативные ощущения после процедуры, но все-таки это лучевая терапия. При раке предстательной железы последствия после нее все же существуют:
- Возникают проблемы с прямой кишкой. Может появиться диарея и синдром раздраженной кишки. Со временем эти неприятности уходят.
- Появляются вопросы, связанные с работой мочевого пузыря и мочеиспусканием. Больной страдает от частого мочеиспускания, жжения во время него и наличия крови в моче. Эти неприятности через некоторое время проходят.
- Развитие импотенции и нарушение эрекции. Частота возникновения этих проблем такая же, как и после хирургического вмешательства. Но существует различие: после операции импотенция развивается сразу же, а после облучения — постепенно, в течение года.
- После того как использовалась лучевая терапия при раке предстательной железы (отзывы пациентов, прошедших через эту процедуру, подтверждают это), в первое время чувствуется постоянная усталость и утомляемость. Это состояние сохраняется пару месяцев.
- Нарушается отток лимфы. Это является причиной отека нижних конечностей.
- Сужение уретры. Иногда повреждается мочеиспускательный канал, нарушается отток мочи.
Как вести себя во время лечения
Многих волнует вопрос: чего ожидать, после того как была проведена лучевая терапия при раке предстательной железы? Эффективность ее зависит от соблюдения следующих правил:
- В период проведения процедуры питание должно быть не только высококалорийным, но и полноценным. Рацион должен включать в себя все витамины и микроэлементы. Обязательно соблюдайте питьевой режим (до трех литров жидкости в сутки).
- Откажитесь от курения и употребления спиртных напитков.
- Одежда должна быть свободной, легкой, из натуральных тканей. Желательно зоны облучения держать открытыми. При выходе на улицу их необходимо защищать от солнца.
- Не пользуйтесь мылом и другой косметикой. Во время принятия душа помните о метках на теле.
- При появлении покраснения, зуда, сильного потоотделения обязательно обратитесь к лечащему врачу.
- Постоянные прогулки на свежем воздухе, соответствующая физическая активность, крепкий и полноценный сон – это еще один шаг к избавлению от недуга.
Жизнь после лучевой терапии
Восстановление начинается сразу же после окончания сеансов облучения. Оно включает в себя такие моменты:
- отдых в течение дня;
- полноценный сон;
- щадящий режим;
- эмоциональный настрой;
- правильное и полноценное питание;
- отказ от всех вредных привычек.
В этот период очень важна помощь не только врача, но и родных людей.
Так как лечение еще не закончено, придется ходить на процедуры и исследования, эмоциональное состояние в связи с этим часто меняется. Главное в этот период — не замыкаться в себе, общаться с друзьями и родственниками. Постарайтесь соблюдать привычный ритм жизни, не отказывайтесь от домашних дел. Если немного устали, лягте, отдохните.
Если вы работаете, попросите руководство хотя бы на некоторое время перевести вас на легкий труд. Лучше всего, конечно, на период реабилитации взять отпуск.
Если будут соблюдаться все рекомендации врача, то реабилитационный период пройдет спокойно, быстро и легко.

Эффективность процедуры
На разных стадиях результаты разные:
- Облучение на первой стадии может заменить хирургическое вмешательство, остаются нетронутыми здоровые органы и ткани.
- После простатэктомии используется лучевая терапия при раке предстательной железы. Последствия после операции в этом случае становятся минимальными, так как уничтожаются патогенные клетки.
- На поздних стадиях болезни облучение уменьшает болевой синдром.
Ваше здоровье — в ваших руках. Старайтесь постоянно посещать врача. Он будет наблюдать за течением болезни и при малейшем ухудшении назначит лечение.
Источник fb.ru
Статьи Комментарии
| »» Содержание | Б.П. Матвеев, Б.В. Бухаркин, В.Б. Матвеев |
Глава 8. Лучевая терапия рака предстательной железы
Лучевая терапия является в настоящее время одним из ведущих консервативных специальных методов лечения рака предстательной железы как при локализованном, так и при местнораспространенном процессе.
Дистанционное облучение с применением мегавольтных источников излучения (гамма-установка, линейные ускорители и др.) рекомендуется сейчас при всех стадиях рака предстательной железы (Алиев Б.М., 1983, Свиридова Т.В., 1994, Amin P.P. et al. 1983, Bagschow М.A., 1983 и др.). Оно является альтернативой радикальной простатэктомии в начальной стадии заболевания, в случае невозможности операции в связи с сопутствующими заболеваниями или отказом больного от оперативного лечения. Лучевая терапия с успехом применяется как в случаях локализованного, так и местнораспространенного рака предстательной железы.
При этом в подходах к лучевому лечению у различных авторов имеются существенные различия, касающиеся техники и технологии облучения, объема лучевого воздействия и суммарных очаговых доз.
Противопоказаниями к проведению лучевой терапии считаются: общее тяжелое состояние больного, раковая кахексия, выраженный цистит и пиелонефрит, наличие большого количества остаточной мочи, хроническая почечная недостаточность, азотемия (Голдобенко Г.В., 1997).
Последнее десятилетие ознаменовалось значительным прогрессом в изучении возможностей лучевой терапии рака предстательной железы. Арсенал средств и методов лечения обогатился новыми подходами к лучевому лечению, ряд которых оказался весьма плодотворным. Популярность ее объясняется рядом очевидных преимуществ перед другими известными терапевтическими методами. Лучевая терапия не оказывает пагубного влияния на сердечно-сосудистую и свертывающую системы крови, изменения которых под воздействием гормонотерапии нередко приводят к преждевременным летальным исходам. В последние годы некоторыми исследователями, даже при ранних стадиях заболевания, лучевой терапии отдается предпочтение перед хирургическим лечением (радикальной простатэктомией), так как отдаленные результаты обоих методов приблизительно одинаковы, но облучение не вызывает столь серьезных лечебных последствий, как хирургическое лечение: 0.5-5% — послеоперационной летальности, 95-100% — импотенции, 10-15% — недержание мочи и пр.
Некоторые литературные данные о выживаемости больных раком предстательной железы, леченных лучевым методом представлены в табл. 34.
Таблица 34. Результаты лучевой терапии рака предстательной железы. Выживаемость за 5 и 10 лет.
| Автор | Кол-во больных |
T1 | T2 | T3 | T4 | |||
| 5 лет | 10 лет | 5 лет | 10 лет | 5 лет | 10 лет | 5 лет | ||
| Kopper B., 1988 | 112 | 83% | 59% | 83% | 59% | |||
| Reed N., 1988 | 168 | 100% | 77% | 42% | ||||
| Howleu P., 1989 | 126 | 92% | 92% | 72% | ||||
| Maruoka M., 1989 | 129 | 100% | 100% | 75% | ||||
| Zagars G., 1989 | 114 | 84% | 68% | 84% | 68% | 72% | 47% | |
| Cuban D., 1990 | 96 | 61% | 61% | |||||
| Prestone J., 1990 | 191 | 79% | 75,5% | 52,5% | 0% | |||
| Abratt P.P., 1990 | 93 | 83% | 83% | 83% | ||||
| Jrumiyama K., 1990 | 33 | 100% | 100% | 65% | 50% | |||
| Lioyd-Da-Vies, 1990 | 209 | 67% | 32% | 67% | 32% | 67% | ||
| Fuse H., 1991 | 41 | 86% | 66% | 47% | ||||
| Kuten A., 1992 | 116 | 84% | 78% | 63% | ||||
| Kaprowsky C., 1992 | 176 | 95% | 80% | |||||
Эффективность радиотерапии больных раком предстательной железы во многом зависит от качества планирования облучения. Планированию лучевой терапии и ее клинико-дозиметрическому обоснованию обычно предшествует топометрическая подготовка больных. С этой целью широко применяются такие виды рентгенологического исследования как компьютерная томография, магнитно-ядерный резонанс и др.
В последние годы для оптимизации лучевой терапии широко применяются компьютерные программы и специальные устройства, так называемое конформальное (conformal) облучение, которые позволяют с учетом гетерогенности тканей и кривизны облучаемого участка в трех проекциях выбрать наиболее рациональные условия лучевого воздействия. В качестве критериев при этом выбрана лучевая нагрузка на наружные подвздошные и обтурационные лимфатические узлы, кожу передней и задней поверхности тела больного, тазобедренный сустав. Характер распределения доз определяют во фронтальной, сагиттальной и горизонтальной плоскостях облучаемого участка тела пациента. При оценке полученных данных исходят из того, что первичная опухоль и зоны регионарного метастазирования должны облучаться равномерно с допустимым градиентом дозы 90-100%, а лучевая нагрузка на тазобедренный сустав, заднюю стенку прямой кишки и на уровне кожных покровов не должна превышать их толерантность.
На основании полученной топометрической информации проводят тщательный анализ распределения доз при различных вариантах дистанционной гамма-терапии. Общим выводом из этих исследований явилось признание рациональности использования при локализованных формах рака предстательной железы подвижных методик дистанционной гамма-терапии, т.е. облучение только первичной опухоли; при распространенности опухоли на регионарные лимфатические узлы — сочетание вариантов подвижного и статического 4-х польного перекрестного облучения с соотношением доз с передних и задних полей 2:1. Показано, что при использовании этих вариантов облучения, лучевая нагрузка на заднюю стенку прямой кишки снижается почти на 20%, на кожные покровы ягодичной области — на 20-30% по сравнению с гамма-терапией с соотношением доз 1:1 и с однозонным подвижным облучением первичной опухоли с углом качания 240° или же двухзонным облучением с углом качания 180°. Лучевая нагрузка на уровне кожных покровов лобковой зоны с соотношением доз 2:1 находится на том же уровне, что и при старых вариантах гамма-терапии с соотношением доз 1:1, составляя 60% от величины очаговой дозы облучения.
На основе комплексного обследования, тщательной дозиметрической подготовки, а также в зависимости от распространенности опухолевого процecca, выделяют следующие варианты дистанционной лучевой терапии рака предстательной железы.
1. Облучение только первичной опухоли. В зависимости от размеров новообразования, распространения его на соседние органы и тканевые структуры, применяется одно- или двухзонная подвижная дистанционная гамма-терапия с требуемыми разведениями осей ротации, углами вращения 90°-120°. При инфильтрации одной или двух боковых стенок таза используется методика двухзонной ротации с углами качания 60°-90°. Размер поля на оси ротации, в зависимости от параметров опухоли, колеблется от 4 х 8 до 9 х 11 см. При этом в зону облучения включается первичная опухоль, шейка мочевого пузыря, передняя стенка прямой кишки с постепенным снижением поглощенных доз в направлении задней ее стенки, а также к тазобедренному суставу, до уровня ниже их толерантности. В зависимости от величины и конфигурации предстательной железы, изменяются размеры полей облучения, сектор качания и расстояние между осями качания в условиях двухзонного подвижного облучения. Если одна из долей железы увеличена, а другая имеет небольшие размеры, необходимо со стороны большего поражения железы увеличить только одно поле облучения. Разовая доза 1,8-2 Гр, суммарная — 65-70 Гр. Перерыв на дозе 30-40 Гр и продолжение облучения через 2-3 недели. Показания: ранние стадии заболевания — T1-2N0M0.
2. Облучение первичной опухоли и регионарных лимфатических узлов таза. Дистанционная гамма-терапия проводится с 4-х статических полей под углом 45° — два поля спереди, два сзади, с соотношением лучевой нагрузки с передних и задних полей 2:1. Для охвата опухоли и путей регионарного метастазирования 90-100% изодозой нижний край поля облучения располагается на уровне ануса, верхний — на уровне первого крестцового позвонка — места перехода внутренней и наружной цепочек лимфатических коллекторов в общую. Наружная граница поля проходит по линии, пересекающей внутренний край вертлужной впадины. После суммарной очаговой дозы 45 Гр поля уменьшаются в размерах и облучение проводится только на первичную опухоль одно- или двухзонной секторной ротацией до общей дозы 65-70 Гр. Углы качания варьируют при однозонной ротации от 90° до 120°, при двухзонной — от 60° до 90°. Облучение осуществляется в дозе 20-25 Гр (РОД 1,8-2 Гр) после перерыва в 2-3 недели. Показания: больные раком предстательной железы в стадии заболевания — T1-2N1-3M0, T3-4N0-x М0. При Т1-2NxM0 — суммарная доза на регионарные лимфатические узлы может быть ограничена дозой 45 Гр, на предстательную железу доза доводится до 65-70 Гр. При наличии метастатического поражения лимфатических узлов, общая суммарная доза на них доводится до 50-60 Гр.
3. Облучение первичной опухоли и лимфатических узлов таза с включением парааортальной и общей подвздошной групп лимфатических коллекторов. Лучевая терапия при этом проводится на фоне приема гормональных препаратов. Сначала облучению подвергается первичная опухоль и регионарные лимфатические узлы до общей очаговой дозы 40-45 Гр. На втором этапе расщепленного курса, после перерыва 2-3 недели, подключается облучение общих подвздошных и парааортальных лимфатических узлов с двух-фигурных полей, имеющих форму перевернутой буквы "U" с экранированием спинного мозга и почек до суммарной очаговой дозы 40 Гр. Затем продолжается облучение первичной опухоли суженными полями подвижным методом до общей очаговой дозы 65-70 Гр при значении разовой дозы 1.8-2 Гр. Показания: распространение опухоли на юкстарегионарные лимфатические узлы — Т1-4N2-3M0.
Больший объем тканей облучают на первом этапе лучевого лечения. Разовую очаговую дозу 1.8-2 Гр подводят ежедневно 5 раз в неделю. Суммарная очаговая доза достигает 45-50 Гр. Затем проводят облучение только предстательной железы и прилежащих тканей. Большинство авторов полагают, что рациональная суммарная очаговая доза, рассчитанная в центре железы должна составлять при Т0-1 — 60 Гр, при Т2 — 60-65 Гр, при Т3 — 65-70 Гр, при Т4 — более 70 Гр. При этом доза на расстоянии 4 см от центра железы должна достигать при Т0-2 -6 0 Гр, при Т3 — 65-70 Гр и при Т4 — более 70 Гр (Hanks G. et al., 1985).
При использовании высокоэнергетического излучения ускорителей (> 10 Мэв) облучение первичной опухоли и лимфатических узлов таза рекомендуется проводить с двух противолежащих полей (переднего и заднего), либо с четырех полей (переднего, заднего и двух боковых). Используя фотоны ниже 18 Мэв, передне-задними полями можно подвести дозу до 45 Гр и дополнительную дозу путем подключения боковых полей (Голдобенко Г.В., 1997).
Последние литературные данные свидетельствуют о серьезных достижениях лучевого метода лечения. Так группа RTOG привела отдаленные результаты лучевого лечения крупнейших лечебных учреждений, занимающихся этой проблемой. Они представлены в табл. 35.
Таблица 35. Отдаленные результаты лучевой терапии рака предстательной железы в % (RTOOG, Dearnaley D. ,1998).
| Стадия | Кол-во больных |
Локальный рецидив | Безрецидивная выживаемость | Общая выживаемость | ||||||
| 5 лет | 10 лет | 15 лет | 5 лет | 10 лет | 15 лет | 5 лет | 10 лет | 15 лет | ||
| Т1 | 583 | 3-6 | 4-8 | 17 | 84-85 | 52-68 | 39 | 83-95 | 52-76 | 41-46 |
| Т2 | 1117 | 12-14 | 17-29 | 32-35 | 66-90 | 27-85 | 15-42 | 74-78 | 43-70 | 22-36 |
| Т3 | 2292 | 12-26 | 19-31 | 25-56 | 32-60 | 14-16 | 17-40 | 56-72 | 32-42 | 23-27 |
Bagshaw M.A. et al.,1994, сообщили отдаленные результаты дистанционной лучевой терапии у 1245 пациентов со стадией Т1-2 при сроке наблюдения 31.5 года (медиана — 7.8 лет). Общая 15-летняя выживаемость больных не имевших метастазов в лимфатические узлы составила 53%.
Hanks et al.,1997, приводят результаты 3-летней (биохимической) безрецидивной выживаемости 233 пациентов с клинической стадией Т3 в зависимости от уровня ПСА перед началом лечения.(табл. 36)
Таблица 36. 3-летняя безрецидивная выживаемость больных раком предстательной железы в стадии Т3 в зависимости от уровня ПСА перед лечением и дозы радиации (Hanks et аl .,1997).
| Доза | ПСА 10-19,9 | ПСА > 20 |
| 70 Гр | 69% | 36% |
| 75 Гр | 80% | 46% |
| 80 Гр | 89% | 57% |
Мнения относительно дополнительных лечебных мероприятий на фоне облучения расходятся. Так И.А. Клименко и соавт.(1976), М.С. Старичков и соавт. (1980), С.И. Ткачев (1982) рекомендуют облучение на фоне гормонотерапии больным в стадии T3-4, Green et al. (1975) считают эстрогенотерапию благоприятной при прогрессирующих опухолях перед началом лучевого лечения с целью уменьшения объема мишени предстоящего облучения. Некоторые авторы (Klosterhalfen et al., 1982) в стадии Т3 дополняют лучевое лечение гормонами и кастрацией. При наличии симптомов инфравезикальной обструкции с хронической задержкой мочи на первом этапе проводят трансуретральную резекцию предстательной железы (ТУР) или операции отведения мочи с последующей (на 2 этапе) лучевой терапией.
В последние годы определенную новизну представляют попытки разработать дифференцированные показания к лучевой терапии в зависимости от степени злокачественности опухоли. С точки зрения Алиева Б.М. (1985) лучевое лечение всех недифференцированных вариантов рака предстательной железы должно вестись на фоне гормонотерапии независимо от стадии. Свиридова Т.В. с соавт. (1984, 1994) расширяют показания к комплексному гормонально-химиолучевому лечению, полагая, что оно должно применяться во всех стадиях низкодифференцированного и анапластического рака, а лучевая терапия в самостоятельном варианте должна использоваться при стадиях Т1-3 высоко- и умеренно-дифференцированного рака без поражения регионарных лимфоузлов.
Данные последних лет свидетельствуют о преимуществе комбинированного гормоно-лучевого лечения у больных раком предстательной железы с неблагоприятным прогнозом. Так в исследовании EORTC, включающем 401 пациента раком предстательной железы в стадии Т1-2 G 3 и стадиях Т3 и Т4 без отдаленных метастазов показано улучшение результатов лечения при применении адъювантной терапии аналогами LНRH, в частности, золадексом (Воllа M. et аl., 1998). Эти данные представлены в табл. 37.
Таблица 37. 5-летние результаты адъювантной гормонотерапии в комбинации с лучевой терапией больных раком предстательной железы в % (EORTC, 1998).
Источник medi.ru
Лечение при раке предстательной железы предполагает применение лучевой терапии, несмотря на ряд негативных последствий, связанных с облучением. Ионизирующее излучение, воздействуя на область поражения, уничтожает злокачественные клетки опухоли путем разрушения их ДНК. Облучение при раке простаты является методом лечения опухоли и предотвращения ее распространения на здоровые ткани. Лечение рака простаты радиотерапией может проводиться дистанционно или внутренне.
Дистанционная лучевая терапия
 Дистанционная радиотерапия предполагает воздействие на ткани простаты мужчины ионизированным излучением вне тела больного. Существует несколько методов проведения такой терапии:
Дистанционная радиотерапия предполагает воздействие на ткани простаты мужчины ионизированным излучением вне тела больного. Существует несколько методов проведения такой терапии:
- Конвенциональная лучевая терапия при раке предстательной железы проводится наиболее часто. Основным материалом для подготовки к терапии являются данные рентгенологических исследований, результаты компьютерной томографии и магнитно-резонансной томографии органа. Излучение воздействует на опухоль под заданным углом.
- 3D-комформная лучевая терапия рака предстательной железы отличается максимальной точностью воздействия на очаг злокачественного образования, поскольку проводится рентгеновским симулятором излучения с компьютерно-томографической приставкой, позволяющей производить облучение сложной конфигурации труднодоступных частей тела. Основными достоинствами данного метода являются: хорошая переносимость терапии пациентом, высокая точность воздействия благодаря данным МРТ, слабое влияние на окружающие ткани, воздействие на опухоль облучением в нужной дозе, использование для процедуры высокоточного оборудования.
- Лучевая интенсивно модулированная терапия простаты (IMRT) – позволяет минимизировать воздействие излучения на другие органы благодаря многолепестковому коллиматору. Лепестки в количестве 20-80 шт.
 управляются компьютером, могут устанавливаться в форму, соответствующую форме опухоли. Планирование радиологического облучения методом IMRT проходит очень тщательно, поскольку здоровые ткани и органы, попадающие в зону облучения, должны быть максимально защищены от воздействия. Допускается, что воздействие менее 60% планируемой дозы излучения получат до 5% тканей, попадающих в зону поражения.
управляются компьютером, могут устанавливаться в форму, соответствующую форме опухоли. Планирование радиологического облучения методом IMRT проходит очень тщательно, поскольку здоровые ткани и органы, попадающие в зону облучения, должны быть максимально защищены от воздействия. Допускается, что воздействие менее 60% планируемой дозы излучения получат до 5% тканей, попадающих в зону поражения. - Стереотаксическая лучевая терапия (SBRT) – предполагает воздействие ионизированного излучения на очаг злокачественного образования. Курс лечения обычно меньше недели.
- Лучевая терапия с коррекцией изображения (IGRT) – позволяет получать изображение опухоли непосредственно при лучевой терапии или перед сеансом. При этом доза излучения, получаемая здоровыми тканями, минимизируется. Одной из разновидностей IGRT является радиотерапия с использованием кибер-ножа (Cyber-Knife). Процедура проводится с использованием кибер-руки со встроенной компьютерной системой планирования излучения на основе данных МРТ. Кибер-рука позволяет облучать участки сложной формы.
Внешние методы воздействие на раковую опухоль часто приводят к появлению ожогов в местах проникновения, ломкости сосудов и кровоизлияний.
Внутренняя лучевая терапия
Возможно воздействие ионизированным излучением на опухоль простаты методом брахитерапии.  Он предполагает контактное влияние на клетки образования источником облучения. Основное преимущество метода – воздействие непосредственно на очаг опухоли. Процесс контролируется с помощью трансректального УЗИ. Радиоактивные зерна в количестве 60-90 шт. вводятся иглой через промежность. В зависимости от времени воздействия вводимых элементов в организме мужчины, брахитерапия может быть двух видов:
Он предполагает контактное влияние на клетки образования источником облучения. Основное преимущество метода – воздействие непосредственно на очаг опухоли. Процесс контролируется с помощью трансректального УЗИ. Радиоактивные зерна в количестве 60-90 шт. вводятся иглой через промежность. В зависимости от времени воздействия вводимых элементов в организме мужчины, брахитерапия может быть двух видов:
- Постоянная – предполагает введение 40-100 радиоактивных зерен йода-135 или палладия-103, которые спустя некоторое время становятся безвредны. Благодаря такой методике воздействие высоких доз радиации на злокачественные клетки максимально, а близлежащие ткани страдают минимально.
При случайном выходе капсулы с радиоактивным веществом через уретру, необходимо взять ее с помощью пинцета, переместить в любую емкость и доставить в больницу для последующей утилизации. - Временная – брахитерапия, при которой воздействие активного вещества (иридия-192) происходит посредством введения полой иглы в область простаты с последующим ее заполнением радиоактивным иридием. После окончания процедуры иглы извлекаются.
 Благодаря брахитерапии 80% пациентов живут еще более 10 лет. Подобная статистика выживаемости наблюдается при проведении радикальной простатэктомии – процедуры, имеющей гораздо более негативные последствия в виде недержания мочи или импотенции.
Благодаря брахитерапии 80% пациентов живут еще более 10 лет. Подобная статистика выживаемости наблюдается при проведении радикальной простатэктомии – процедуры, имеющей гораздо более негативные последствия в виде недержания мочи или импотенции.
Чем раньше начать лечить рак простаты с помощью радиологического излучения, тем меньше осложнений он принесет и тем выше выживаемость пациента. Согласно статистическим исследованиям группы испытуемых из 665 мужчин, выживаемость в течение 12 лет после брахитерапии и сочетанной лучевой терапии составила 99,7%. Наиболее хорошие прогнозы у людей с низким ПСА, имеющим незначительно увеличенную предстательную железу, оценку опухоли по шкале Глисона более 7 (показатель имеет значения от 1 до 10; чем он ниже, тем хуже прогноз).
Несмотря на доказанную эффективность лучевой терапии, ее проведение имеет ряд негативных последствий для больного.
Побочные эффекты лучевой терапии
Гормонотерапия и лучевая терапия при раке простаты – оптимально сочетающиеся методы лечения онкозаболевания простаты. Основные последствия лучевой терапии при раке простаты связаны с повреждением здоровых клеток. Осложнения могут проявиться в течение первых 3 месяцев после процедуры, а могут возникнуть через длительный промежуток времени – от 3 месяцев до 2 лет. К ранним проявлениям осложнений относятся:
- расстройства кишечника: понос, вздутие, запор;
- дизурические расстройства различной степени тяжести;

- задержка мочи;
- воспаление мочевого пузыря (цистит);
- ректит – воспаление слизистой прямой кишки, ее отек, покраснение, в тяжелых случаях – отторжение эпителиальной ткани.
В более позднем периоде дают о себе знать:
- уретрит – воспаление мочеиспускательного канала;
- стриктура уретры – нарушение просвета уретры за счет образования рубцовой ткани;
- поверхностный некроз уретры;
- лучевой фиброз – нарушение проходимости кровеносных сосудов вследствие уплотнения соединительной ткани и образования рубцов;
- гидронефроз почек;
- импотенция.
Наиболее частыми являются нарушения работы желудочно-кишечного тракта, мочевыделительной и половой систем.
Повреждение кишечника и нарушение его функций
 Повреждения в области прямой кишки находятся на расстоянии около 10 см от ануса и представляют собой язвы, эрозию слизистой ткани. Биопсия таких тканей крайне нежелательна, поскольку такая процедура чревата возникновением свищей. Игнорирование ректита может стать причиной летального схода больного.
Повреждения в области прямой кишки находятся на расстоянии около 10 см от ануса и представляют собой язвы, эрозию слизистой ткани. Биопсия таких тканей крайне нежелательна, поскольку такая процедура чревата возникновением свищей. Игнорирование ректита может стать причиной летального схода больного.
Часто после лучевой терапии рака простаты возникает диарея, неконтролируемые каловые выделения, появление крови из прямой кишки при походе в туалет. После привыкания организма к новым размерам простаты расстройства кишечника обычно прекращаются.
Расстройства мочеполовой системы
Во время облучения простаты наиболее подвержена негативному влиянию лучевого излучения нижняя стенка (дно) мочевого пузыря. У 25% мужчин наблюдалась необходимость применения впитывающих прокладок из-за подтекания мочи. Примерно через год нарушения проходят самостоятельно. Если этого не произошло, применяется медикаментозная терапия. В сравнении с дистанционным методом, вероятность поражения мочевыделительной системы  при брахитерапии в 3 раза выше.
при брахитерапии в 3 раза выше.
Свободный выход мочи может быть нарушен по причине фиброза тканей. Этот процесс практически необратим, поэтому чем раньше начато лечение лучевого фиброза, тем меньше негативных последствий он повлечет. Согласно статистическим данным, средние сроки обращения с разного рода последствиями лучевой терапии составили от 1 до 2 лет после проведения процедуры. В 97% случаев наблюдались нарушения потенции, которые носили долгосрочный характер.
Импотенция после лучевой терапии лечится с помощью препарата Виагра. Положительный результат был отмечен в 50-60% случаях применения препарата. При несостоятельности данного метода лечения могут применяться инъекции препаратов в половой орган непосредственно перед сексом. Эффективность метода достигает 80%, однако его существенным недостатком является боль при введении лекарства и риск образования рубцовой ткани в месте укола.
Максимальный положительный результат восстановления потенции (около 95%) достигается при использовании пенильных имплантов. Их установка предпочтительна, если никакие другие методы не помогли. Имплант с помощью хирургического вмешательства вставляется в половой член, благодаря чему мужчина сможет заниматься сексом с партнершей.
Уменьшение негативного влияния радиотерапии
Несмотря на ряд возможных осложнений, лучевая терапия рассматривается как альтернативный метод лечения рака предстательной железы, поскольку влияет на очаг злокачественного образования следующим образом:
- убивает злокачественные клетки, препятствует их размножению;

- способствует тромбированию сосудов, доставляющих злокачественным клеткам питательные вещества;
- имеет более низкую вероятность осложнений в сравнении с радикальной простатэктомией.
Для минимизации негативного влияния радиотерапии можно воспользоваться рекомендациями профессора Голдобенко Г.В. – первого президента Российской Ассоциации терапевтических радиационных онкологов:
- придерживаться принципов здорового питания, исключив из рациона соленую пищу и алкогольные напитки;
- следить за гигиеной промежности;
- перед лечением провериться на наличие мочеполовых инфекций; при цистите или пиелонефрите принять курс антибактериальной терапии, подобрав препараты на основании бакпосева мочи;
- при затруднении опорожнения мочевого пузыря начать терапию рака простаты с применения гормональной терапии, а облучение проводить начиная с минимальных доз радиации (от 0,5 Гр при первом сеансе до 2 Гр к 4 сеансу);
- после процедуры трансуретральной резекции мочевого пузыря (ТУР) выдержать период не менее 1 месяца;
- отказаться от любого механического воздействия на уретру перед процедурой;

- для мужчин в тяжелом состоянии делать перерыв между этапами радиотерапии в 2-3 недели;
- при первых проявлениях лучевого ректита использовать ректальные свечи с содержанием белладонны, метилурацила, анестезина, делать микроклизмы с лечебными маслами.
Первые 2 месяца после проведения процедуры стоит воздержаться от держания на коленях маленьких детей и исключить присутствие рядом женщин, находящихся в положении. Также для избегания негативных последствий после терапии нельзя поднимать предметы, вес которых превышает 4 кг. Не рекомендуется оставаться в сидячем положении боле 2 часов подряд. Нужно следить, чтобы мочевой пузырь или кишечник не были переполнены.
Если придерживаться предложенных рекомендаций, лечение рака простаты с помощью воздействия ионизированного излучения пройдет с минимальными осложнениями.
Источник prozhelezu.ru