Ультразвуковые исследования в диагностике рака предстательной железы
Трансректальное ультразвуковое сканирование обладает явным преимуществом по сравнению с абдоминальным сканированием ввиду близкого соприкосновения датчика с предстательной железой.
Сканирование в сагиттальной и фронтальной проекциях позволяет наиболее полно обследовать предстательную железу.
Появившиеся в последнее время технические возможности (цветная допплерография и трехмерное сканирование с использованием контрастных средств) значительно повысили диагностические возможности данного вида исследования.
Случаи рака предстательной железы выглядят гипоэхогенными зонами при трансректальном ультразвуковом исследовании (ТРУЗИ), хотя они могут быть и изоэхогенными, а иногда и гиперэхогенными. Наличие других изменений в предстательной железе в виде асимметрии размеров, формы и эхогенности, нечеткое разделение между центральной и периферическими зонами, деформация и деструкция капсулы также позволяют заподозрить наличие рака при выполнении ТРУЗИ.
Деформация и неправильная форма капсулы в участках, прилегающих к гипоэхогенному узду предстательной железы, позволяют предположить экстрапростатическое распространение опухоли. Трансректальное ультразвуковое исследование можно использовать для определения инвазии в семенные пузырьки. Однако ТРУЗИ не может считаться достоверным методом в оценке стадии процесса. Чувствительность этого метода определена в пределах 71-92%, специфичность — 49-79%. По мнению R.L. Waterhouse, M.I. Resnick (1998), трансректальное ультразвуковое исследование имеет прогностическое значение в 30% случаев.
Гораздо большее, хотя и неоднозначное, значение в определении стадии имеют компьютерная и магнитно-резонансная томография.
Мнения ученых о ценности клинического применения компьютерной томографии (КТ) для определения распространенности рака предстательной железы диаметрально противоположны. По мнению С.К. Ноn и соавт. (1998), G.J. Jager и соавт. (2000), компьютерная томография имеет незначительное значение или вовсе не играет роли при оценке локального процесса.
Она не позволяет отличить злокачественный процесс от доброкачественного и достоверно определить наличие экстракапсулярной инвазии или инфильтрации семенных пузырьков. В стадиях Т3-Т4 КТ демонстрирует увеличение железы, распространение инфильтрата на окружающие органы. В стадиях Т1-Т2 возможности ограничены из-за практически одинаковой плотности тканей.
Точность компьютерной томографии в стадировании рака предстательной железы невелика и составляет менее 60%, но ее ценность, по мнению R.C. Flangian и соавт. (1996), возрастает при оценке вовлечения в процесс семенных пузырьков до 70%.
Итак, клиническое применение компьютерной томографии в определении стадии рака простаты в целом не оправдано. КТ играет минимальную роль в опенке локальной формы болезни, она не демонстрирует внутреннюю архитектонику железы, не способна различить рак и доброкачественный процесс в простате и надежно идентифицировать экстракапсулярное распространение или инвазию в семенные пузырьки. Компьютерная томография не обеспечивает дополнительной информацией для сталирования локальной формы болезни в большей степени, чем пальцевое ректальное исследование.
Из-за низкого определения позитивных лимфатических узлов ценность применения КТ для этих целей также незначительна. Большинство лимфатических метастазов микроскопические, и они не увеличивают или не искажают лимфатические узлы.
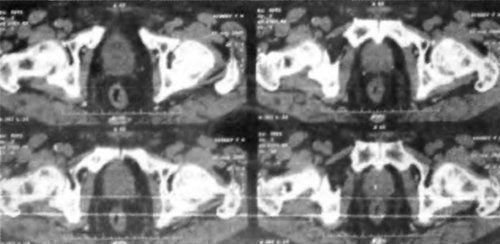
Достоверно доказано, что есть группы пациентов, для которых риск поражения лимфатических узлов может быть выше: Простатспецифический антиген (ПСА) от 20 до 30 нг/мл или низкодифференцированная опухоль (сумма Gleason >7 при биопсии) определяет риск макроскопических изменений, что оправдывает проведение КТ. Необходимо обратить внимание на то, что при наличии увеличенного лимфатического узла, выявленного на компьютерной томографии, необходимо подтвердить злокачественный процесс в ткани самой железы (рис. 3.7).

Рис. 3.7. Диссеминированный рак предстательной железы. Выход за пределы капсулы железы, инвазия в сосудисто-нервный пучок. Поражение лимфатических узлов по ходу подвздошных сосудов
Кроме того, внедрение в клиническую практику современных методов диагностики и скрининговых программ позволяет выявлять ранние стадии рака, поэтому метастазы в лимфатические узлы обнаруживаются гораздо реже.
13 настоящее время только у 2-3% пациентов, перенесших радикальную простатэктомию (РПЭ) по поводу локального рака, диагностируются метастазы в лимфатические узлы на основании послеоперационного гистологического исследования. Низкая частота позитивных тазовых лимфатических узлов до РПЭ побуждает хирургов отказаться от лимфаденэктомии во многих случаях.
Широко известны номограммы, которые позволяют прогнозировать риск наличия метастазов, и если риск наличия метастазов меньше 2%, лимфаденэктомия может не выполняться. Эти номограммы включают следующие параметры: клиническую стадию, гистологическую степень дифференцировки и уровень ПСА.
МРТ при стадировании рака простаты
Магнитно-резонансная томография при раке предстательной железы (РПЖ) обладает рядом преимуществ. Различная интенсивность сигнала от мягких тканей таза позволяет дифференцировать его различные структуры, использование T1 и Т2-взвешенных изображений взаимно дополняет друг друга. Магнитно-резонансная томография (МРТ) сканеры способны к созданию изображений в поперечной, сагиттальной и коронарной проекциях, а применение эндоректального датчика улучшает визуализацию интра- и ретропростатической анатомии.
При использовании только Т1-взвешенных изображений невозможно оценить внутреннюю архитектонику простаты, хотя ясно видны границы между простатой, семенными пузырьками и окружающим жиром, в то время как Т2-взвешенные изображения способны продемонстрировать интрапростатическую анатомию. В норме периферическая зона предстательной железы возвращает сигналы высокой интенсивности, в то время как рак простаты отображается сигналами относительно низкой интенсивности (рис. 3.8).

Рис. 3.8. РПЖ. T3NXM0. Аксиальные Т2-ВИ предстательной железы. Размеры железы не увеличены. Зональная дифференциация снижена, периферическая зона сохранена фрагментарно. Периферическая зона в задних и заднебоковых отделах слева замешена зоной диффузного понижения интенсивности сигнала на Т2-ВИ с инвазией капсулы железы на большом протяжении и выраженным распространением на прилежащую парапростатическую клетчатку
N. Bloch и соавт. (2003), оценивая эффективность различных типов изображений МРТ в стадировании пациентов перед радикальной простатэктомией, показали точность стадирования при Т1-взвешенных изображениях у 76% пациентов, при Т2-взвешенных — у 84%, а при их комбинации — у 92%.
Однако большинство доброкачественных заболеваний простаты, таких как доброкачественная гиперплазия предстательной железы (ДГПЖ), простатит, особенно калькулезный, также отображаются сигналами низкой интенсивности. Более того, МРТ не продемонстрировала большую точность стадирования рака по сравнению с ТРУЗИ. Вместе с тем дополнение поперечных (аксиальных) сканов коронарным и сагиттальным сканированием позволяет увеличить точность стадирования РПЖ с 61 до 83%.
Наличие на томограммах экстракапсулярного распространения рака простаты можно предположить, если есть очевидная асимметрия, нерегулярность или «бреши» в перипростатическом жире, который в отличие от простаты посылает сигналы низкой интенсивности.
Таким образом, при магнитно-резонансной томографии существуют проблемы относительно диагностики экстракапсулярного распространения. В действительности у предстательной железы нет истинной эпидермальной капсулы и инфильтрация тонкой фибромускулярной капсулы указывает на распространение процесса за пределы железы. МРТ не может идентифицировать микроскопическую пенетрацию за границу простаты и поэтому ограничена в обнаружении прорастания рака.
Опухоль может быть описана как Т2, то есть без пенетрации капсулы, даже если существует широкая область контакта между ней и краем железы, пока края железы не деформированы, так же, как и опухоль, где широкая область контакта сочетается с капсулой и гладкое капсульное выпячивание классифицируется как опухоль стадии Т2.
Нерегулярная выпуклость края простаты, асимметрия нервно-сосудистых пучков (связок) или исчезновение ретропростатического угла указывают на стадию Т3. При стадии Т3 потеря симметрии между нервно-сосудистыми пучками связана с прямым экстрапростатическим распространением рака с периневральными и периваскулярными компонентами.
Точно так же потеря нормального слоя жира между задней поверхностью простаты и передней поверхностью прямой кишки указывает на распространение процесса в перипростатический жир. Когда определяются асимметрия сосудисто-нервных пучков и облитерация ретропростатического угла, стадия Т3 может быть диагностирована с высокой степенью вероятности (рис. 3.9).

Рис. 3.9. РПЖ стадии T3NXM0. Аксиальные Т2-ВИ изображения предстательной железы. Размеры железы умеренно увеличены. Зональная дифференциация снижена, периферическая зона сохранена незначительно, фрагментарно, в правых боковых и левых заднебоковых отделах. В правых заднебоковых отделах определяется протяженная зона понижения интенсивности сигнала с выраженной на большом протяжении инвазией капсулы и инфильтрацией прилежащей парапростатической клетчатки. В левых боковых и центральных отделах железы выявляется диффузная зона снижения сигнала с умеренно выраженной инвазией капсулы. Умеренно выражен отек парапростатической клетчатки по левым боковым отделам железы
R. Palasak и соавт. (2003) выполнили 66 пациентам МРТ перед радикальной простатэктомией и сравнили ее результаты с послеоперационными гистологическими заключениями. Точность стадирования составила 81,8%. В то же время S.A. Brassell и соавт. (2003) показали корреляцию МРТ-стадирования с патологической стадией только у 43% пациентов.
Вовлечение семенных пузырьков определяется присутствием фокуса или диффузных областей низкой плотности вокруг или в пределах семенных пузырьков на Т2-изображениях (рис. 3.10).

Рис. 3.10. РПЖ в стадии T3NXM0. Саггиттальные Т2-ВИ изображения предстательной железы. Размеры железы увеличены за счет гиперплазии центральной зоны. Периферическая зона истончена, с неравномерной инвазией, более выраженной в задневерхних отделах, с инфильтрацией парапапростатической клетчатки и медиальных отделов семенных пузырьков. МР картина опухолевого поражения периферической зоны предстательной железы на фоне гипереплазии ее центральной зоны с протяженной инвазией капсулы и инфильтрацией парапростатической клетчатки и семенных пузырьков
Инвазия в семенные пузырьки указывает на сталию Т3 болезни, которая обычно рассматривается как неоперабельная. Однако существует ряд других заболеваний, которые могут быть причинами подобных проявлений, например неспецифический фиброз, геморрагии после биопсии, амилоидоз, склероз после лучевой терапии.
Магнитно-резонансной томография имеет признаки вовлечения семенных пузырьков хотя и чувствительны, но относительно неспецифичны. Проблема геморрагии после биопсии — также фактор, который влияет на точность МРТ в обнаружении вовлечения в патологический процесс семенных пузырьков.
Геморрагии после биопсии и рак простаты одинаково могут проявляться сигналами низкой интенсивности на Т2-изображениях. Однако они могут дифференцироваться на Т1-изображениях, где постбиопсийные геморрагии проявляются сигналом яркой интенсивности, а опухоль остается гипоинтенсивной.
МРТ при локализованных формах рака простаты включает оценку состояния тазовых и внутрибрюшинных лимфатических узлов (рис. 3.11).

Рис. 3.11. Метастазы в лимфатические узлы
Исследование информативно, когда критериями метастатического поражения лимфатических узлов являются их размеры. Так же как и КТ, магнитно-резонансная томография не способна обнаружить микрометастазы в лимфатические узлы.
Радионуклидное сканирование костей
Осевой скелет — предпочтительное место для метастазирования рака простаты. Наиболее чувствительный и широко используемый метод обнаружения костных метастазов — сцинтиграфия костей с 99т-технецием. Ложноотрицательные результаты встречаются менее чем у 1 % пациентов (из-за присутствия широко распространенных симметричных метастазов).
В то же время ложноположительные результаты относительно часты, поскольку сканирование диагностирует не только метастазы, но и дегенеративные изменения, предшествующую травму, излеченные переломы, нарушение обмена веществ и воспалительно-инфекционные повреждения скелета.
Результат положительного сканирования костей может сопровождаться подтверждающими рентгеновскими снимками, хотя в половине случаев изменения костного скелета появляются прежде, чем повреждение может быть обнаружено простыми рентгенограммами.
МРТ может быть полезно в дифференциальном диагнозе подозрительных областей, выявленных при сканировании, когда они не проявляются на простых рентгенограммах, особенно в осевом скелете. Еще 10-15 лет назад радионуклидное сканирование костей скелета выполнялось часто, так как метастатическое поражение костей скелета наблюдаюсь у 30-35% пациентов с первично выявленным раком простаты. Сегодня эта цифра в США составляет менее 5%.
F.M. Chybowski и соавт. (1991) впервые поставили под сомнение необходимость радионуклидного сканирования всем пациентам с впервые выявленным раком простаты. Отрицательные результаты сканирования костей были получены у 99,7% больных с уровнем ПСА менее 20 нг/мл. В 1995 г. группа экспертов Американской ассоциации урологов заявила, что сканирование костей «больше не является обязательным» для пациентов с впервые диагностированным раком простаты, уровнем простатспецифического антигена менее 10 нг/мл и отсутствием «костных» симптомов.
Итак, радионуклидное сканирование костей скелета рекомендуется:
• пациентам с клиническими стадиями Т1 и Т2 при уровне ПСА >10 нг/мл и сумме баллов по шкале Глисона >8;
• пациентам с клиническими стадиями Т3 и Т4;
• пациентам с «костными» симптомами.
Лимфаденэктомия
С началом эры ПСА у большего количества мужчин рак простаты стал выявляться в локализованной форме, которая вылечивается с помощью радикальной простатэктомии.
Рак предстательной железы склонен к инвазии и метастазированию, поэтому так остро стоит вопрос о ранней диагностике и радикальном лечении больных с локализованными формами РПЖ. Точное знание распространенности заболевания крайне необходимо до начала лечения.
Диагностика лимфогенных метастазов в малом тазе сложна, и имеется большая вероятность ошибки (50-60%) даже при применении всех современных методов диагностики. Ультразвуковое исследование, рентгеновская компьютерная томография, магнитно-резонансная томография могут выявить метастазы, когда размер лимфатических узлов превышает 2 см в диаметре, однако эти методы диагностики не позволяют обнаружить мелкие и микроскопические метастазы.
Одним из существенных недостатков этих методов является отсутствие возможности получения биопсии лимфатического узла для морфологической верификации диагноза, которая является истинно объективным критерием оценки состояния регионарных лимфатических узлов.
Самую надежную информацию можно получить после тазовой лимфаденэктомии с последующим гистологическим исследованием лимфатических узлов методом ступенчатых срезов.
В урологии наибольшее распространение при определении стадии рака предстательной железы получила лапароскопическая тазовая лимфаденэктомия (ЛТЛ). D. Fahlenhamp и соавт. (1997) произвели билатеральную ЛТЛ у 200 пациентов РПЖ с клиническими стадиями Т1-Т3 и уровнем простатспецифического антигена в среднем 44 нг/мл. Удалялось в среднем 11 лимфоузлов. Метастазы в лимфатических узлах были обнаружены у 44 (22%) пациентов. Незначительные осложнения были у 15 (7,5%), серьезные возникли у 8 больных и потребовали открытой ревизии.
Таким образом, с учетом вышеизложенного можно заключить, что ЛТЛ позволяет обнаружить метастазы в тазовых лимфатических узлах, которые не выявлены традиционными методами исследования; определить целесообразность радикального хирургического лечения; обоснованно применить методы системного воздействия на опухолевый процесс.
Искусственные нейронные сети
В урологической практике постоянно присутствует необходимость клинического прогнозирования течения болезни индивидуально для каждого пациента. Прогнозирование может касаться распределения пациентов по группам риска, постановки диагноза, прогнозирования стадии рака, результатов лечения, вероятности рецидива болезни и т.д.
Традиционно прогнозирование основано на статистических классификационных моделях, предполагающих в лучшем случае установление статистических взаимоотношений, которые позволяют определить только ограниченные типы относительно простых нелинейных межпеременных взаимосвязей и в худшем случае допускают линейные отношения среди всех переменных.
Поскольку клинические данные характеризуются большим разбросом, им присущи нелинейные межпеременные взаимосвязи, поэтому статистические модели часто теряют желательную точность, когда используются в клинической урологической практике.
Применение искусственного интеллекта при раке предстательной железы преследует решение следующих задач:
• скрининг рака предстательной железы;
• диагностику рака простаты;
• стадирование опухолевого процесса;
• прогнозирование развития опухоли;
• прогнозирование результатов лечения.
В 1994 г. Snow и соавт. впервые сообщили об использовании ретроспективного программирования (обратного распространения) искусственной нейронной сети (ИНС), для предсказания вероятности положительной биопсии простаты при скрининге населения. Они развили ИНС, которая могла предсказывать вероятность наличия рака простаты при биопсии с чувствительностью 70%, специфичностью 92% и точностью 87%. Эта сеть, которая использовала доклинические переменные (возраст, общий ПСА, результаты ТРУЗИ и пальцевое ректальное исследование (ПРИ), была сформирована более чем на 1500 случаях и прошла проверку на новых 200 контрольных случаях.
Считается, что наиболее важными показателями для анализа с помощью искусственного интеллекта являются свободный ПСА (или же процент его отношения к общему ПСА) и данные ТРУЗИ. Выявлено, что диагностика с помощью искусственных нейросетей позволяет достичь точности от 70 до 85%. Успешно применена нейросетевая технология для формирования групп пациентов с высокой и низкой вероятностью распространения злокачественного процесса в регионарные лимфатические узлы.
Тестирование системы во многих медицинских центрах определило точность прогноза в 98-99% случаев в группе с низкой вероятностью лимфогенного метастазирования (около 57% всех пациентов) и точность прогноза, равную 25% при чувствительности 95% в группе с высокой вероятностью лимфогенного метастазирования.
Нейронные сети, должным образом обученные, демонстрируют превосходящую прогностическую точность по отношению к регрессионному анализу со множественными переменными.
Большинство существующих исследований, где используются ИНС при раке простаты, были выполнены ретроспективно при изучении базы данных. Чтобы должным образом оценить ИНС, необходимы большие проспективные исследования.
При дальнейшем развитии онкологии, выявлении новых опухолевых маркеров искусственные нейросети будут играть все большую роль в раннем выявлении, диагностике, стадировании и лечении рака предстательной железы. Более того, эффективность использования такого мощного инструмента повышается в тех случаях, когда в распоряжении врача имеется множество изменяющихся параметров, а их взаимосвязь друг с другом недостаточно известна.
В урологической клинике Российской медицинской академии последипломного образования на базе клинической больницы им. С.П. Боткина сотрудником кафедры И.В. Лукьяновым (2001) впервые были применены элементы искусственного интеллекта для оптимизации диагностической и лечебной тактики у пациентов, страдающих доброкачественной гиперплазией простаты.
В заключение приводим алгоритм диагностики при подозрении на рак предстательной железы, предложенной R.S. Kirby (2003) и Б.П. Матвеевым (2003).
Алгоритм диагностики при подозрении на рак предстательной железы
Источник medbe.ru

На данном этапе времени одним из наиболее популярных и качественных методик осмотра предстательной железы является магнитно-резонансная томография. МРТ при раке простаты является просто незаменимой, поскольку позволяет выявить наличие болезни на ранних сроках, а также отслеживать процесс её протекания.
Рад вас снова видеть на блоге, дорогие читатели. На связи Александр Бурусов и сегодня мы подробно поговорим о диагностике рака простаты с помощью такой процедуры как МРТ. Давайте начинать!
Показания к проведению МРТ
Чаще всего проводят МРТ при раке простаты. С мощью данной процедуры в первую очередь выявляется, где именно расположена злокачественная опухоль: только в районе предстательной железы или же уже вышла за её пределы.
В случае наличия рака предстательной железы у пациента могут присутствовать следующие симптомы (они являются непосредственным показателем необходимости проведения магнитно-резонансной томографии):
- проблемы с отделением мочи;
- ощущение неполного освобождения мочевого пузыря;
- в ночное время выделяется гораздо большее количество мочи, нежели в дневное.
При этом раковое образование не является единственной проблемой, которую можно выявить с помощью магнитно-резонансной томографии.
Эта процедура помогает выявить ещё и ряд следующих болезней:
- болезни инфекционного характера (простатит, абсцесс в области предстательной железы);
- аденому простаты;
- патологии врождённого характера;
- серьёзные проблемы в области тазовых органов, полученные после проведения различного рода операций.
В любом случае стоит ли проводить данную процедуру решает лечащий врач.
Подготовительные моменты к выполнению МРТ
Если осуществляется МРТ аденомы простаты или рака предстательной железы, то обязательным условием перед выполнением данной процедуры является отказ от применения пищи, которая содержит в себе большое количество клетчатки, минимум за 12 часов до исследования. Если в ходе процедуры применяется трансректальный датчик, то потребуется ещё и ввести очищающую клизму в прямую кишку.
Относительно одежды, можно проводить МРТ простаты в одноразовой одежде, предоставляемой медицинским учреждением, или в собственной одежде, но только при условии, что на ней отсутствует фурнитура из металла.
Если во время процедуры необходимо вводить контрастное вещество, то медики в обязательном порядке должны проверить имеется ли у пациента аллергия на это вещество. Кроме того, у больного нужно уточнить страдает ли он от бронхиальной астмы.
От выполнения МРТ следует отказаться при наличии различного рода патологиях почек. А у больных, страдающих от клаустрофобии, диагностику патологий простаты проводят в специальных аппаратах открытого типа.
Обязательным условием при выявлении патологий простаты в аппарате для МРТ считается удаление различных предметов, в составе которых содержится металл, в это число входят следующие:
- нательные ювелирные украшения, часы, слуховые аппараты – в процессе процедуры могут повредиться;
- разнообразные металлические украшения на одежде – могут спровоцировать неточности в итоговом результате;
- съемный тип зубных протезов, которые содержат в себе металлические вставки;
- пирсинг на любой из зон тела.
Строго запрещено делать МРТ в случае присутствия следующих элементов в теле:
- кохлеарные импланты;
- ряд разновидностей клипс, которые применяются на аневризмах в мозге;
- ряд разновидностей клипс, которые располагаются в области кровеносных сосудов;
- клапаны искусственного типа в области сердца;
- импланты инфузионных помп;
- дефибрилляторы и кардиостимуляторы;
- металлические эндопротезы в зоне суставов;
- различного рода винты и штифты из металла;
- присутствие в теле различных металлических частей, к примеру, осколки или пули.
Если процедура осуществляется ребенку, то родители, которые их сопровождают, тоже обязаны убрать у себя все элементы содержащие металл или предупредить докторов о присутствии у себя имплантов, в составе которых содержится металл.
Особенности проведения процедуры
Классический аппарат МРТ являет собой трубку цилиндрического типа и больших размеров, по кругу которой размещены магниты. Больной во время процедуры лежит на передвижном стуле, который постепенно смещается к центру магнита.
Открытый вид аппарата для МРТ характеризуется тем, что магнит расположен не полностью по кругу, а открыт с боковых сторон. Данный тип аппаратов особенно полезен для людей, которые имеют лишний вес или страдают от клаустрофобии.
В процессе выполнения исследования больной должен не двигаясь лежать на протяжении получаса. В случае использования контрастного вещества длительность процедуры увеличивается приблизительно на пятнадцать минут.
Процедура не должна доставлять пациенту никаких болезненных ощущений, тем не менее, ряд больных может чувствовать тепло в зоне предстательной железы. После окончания процедуры никаких восстановительных мер не требуется.
Результаты МРТ при патологиях простаты
Когда происходит диагностирование рака предстательной железы с помощью МРТ, то пораженные злокачественным образованием зоны выявляются как участки пониженного МР-сигнала, а нормальная периферическая зона простаты в свою очередь имеет повышенный МР-сигнал.
Не последнюю роль данный метод исследования играет в диагностировании метастазов рака простаты: это включает как костные, так и лимфатические метастазы.
Если в процессе исследования применялось контрастное вещество, то в случае наличия рака простаты в периферической зоне железы наблюдается снижение интенсивности МР-сигналов различных размеров и форм, которые осуществляют активное накопление контрастного вещества.
При наличии аденомы простаты МРТ характеризуется значительным увеличением центральной части железы, которая выделяется неоднородностью МР-сигналов с увеличенным или уменьшенным количеством гиперинтенсивных включений.
На данном этапе времени многие задаются вопросом, может ли аденома простаты перерасти в рак. Ответ на этот вопрос – отрицательный. Поэтому если у вас была ранее диагностирована аденома простаты, не следует бояться того что на очередной процедуре магнитно-резонансной томографии врач сообщит вам что аденома перерождается в рак — это невозможно.
МРТ – это один из важнейших методов диагностики патологий простаты в современном мире, поскольку с его помощью можно выявить наличие таких болезней как аденома простаты и рак предстательной железы на ранних стадиях, что позволит купировать болезнь, пока она не принесла непоправимые последствия для человеческого организма.
Источник viva-man.ru
Рак предстательной железы (РПЖ) – актуальная проблема современной онкологии, т.к. заболеваемость растет, а своевременное установление диагноза часто затруднительно из-за низкой специфичности основных неинвазивных исследований.
Как известно, существуют три базовых метода, которые применяют в качестве скрининга при РПЖ:
- Пальцевое ректальное исследование – ПРИ.
- Определение в сыворотке уровня PSA (простатоспецифического антигена).
- Трансректальное ультразвуковое исследование (ТРУЗИ).
Точность диагностики при помощи этих методов не превышает 33%.
«Золотым стандартом» постановки диагноза остается биопсия органа. Но это инвазивное вмешательство, проведение его сопряжено с определенными трудностями и иногда несогласием пациента, к тому же эта процедура также не всегда позволяет верифицировать опухоль с первого раза.

Поэтому так актуально применение других неинвазивных способов диагностики, превышающих специфичность традиционных обследований. Огромную роль здесь играет МРТ.
Суть метода МРТ
Магнитно-резонансная томография на сегодняшний день является, пожалуй, самым точным методом визуализации. Преимущества: исследование безболезненно, безопасно для здоровья, намного информативнее других неинвазивных вариантов.
Принцип – воздействие магнитного поля на клетки, а точнее – на атомы водорода в них. Известно, что организм человека на 80% состоит из воды, и водород, соответственно, присутствуют во всех структурах. Это простейший атом, состоящий из одного протона и электрона. Протон находится в постоянном вращении и имеет собственный магнитный момент.
Во время диагностической процедуры человек помещается в сильное постоянное магнитное поле. Одновременно на него воздействуют переменным электромагнитным излучением. Под влиянием радиочастотного сигнала атомы водорода выстраиваются особым образом (намагничиваются), а при прекращении воздействия – возвращаются в исходное состояние (релаксация). Этот момент возврата сопровождается высвобождением энергии, которую фиксирует аппарат МРТ, получая четкое анатомическое изображение.
Время, за которое происходит релаксация, изменяется в зависимости от вида ткани и наличия патологии в ней. Выделяют два варианта:
- T1- продольная релаксация.
- T2 – поперечная релаксация.
Соответственно получают T1 и T2-взвешенные изображения ( T1 ВИ, T2 ВИ).
Снимки получаемых сигналов проводятся послойно и из нескольких проекций, в результате формируется трехмерная картина исследуемой области. На T1ВИ хорошо видны анатомические структуры и окружающие ткани, T2ВИ – лучше просматривают патологические изменения в самом органе.
МРТ не несет в себе вредного излучения, но противопоказана при наличии в организме электронных устройств и имплантатов из намагничивающихся сплавов.
Роль МРТ при диагностике РПЖ
Магнитно-резонансная томография не является рутинным методом. Назначение ее для первичной диагностики рака простаты неоправданно. Проводят его:
- При сомнительных данных основных методов (пальцевого ректального исследования, ТРУЗИ, повышенном уровне ПСА).
- При сохраняющемся подозрении на РПЖ и отрицательных результатах биопсии.
- После подтвержденной гистологической структуры – для уточнения стадии новообразования.
- Обязательна при выявлении очагов > 0,5 см и суммой баллов по Глисону>7, а также при опухолях более 1 см и любым индексом злокачественности.
- Иногда – для определения места забора ткани на анализ (прицельная биопсия с использованием технологии совмещения данных МРТ и УЗИ –Fusion Biopsy). Перед проведением брахитерапии или дистанционной лучевой терапии – для получения 3D мишени.
- МРТ при раке простаты используется и как метод контроля и динамического наблюдения после лечения.
Возможности
Оценить состояние предстательной железы.
Уточнить размеры и распространение опухоли, диагностированной при помощи УЗИ.
Увидеть рак в начальной стадии в передних отделах периферической зоны, которые недоступны ТРУЗИ.
Установление прорастания капсулы железы.
Вовлечения в процесс уретры, мочевого пузыря, окружающей клетчатки, семенных пузырьков.
Диагностика поражения лимфатических узлов.
Определение метастатических очагов в костях таза, крестца.
Противопоказания к МРТ
Электронные и различные намагничивающиеся имплантаты в организме являются противопоказанием к проведению МРТ. Они могут выйти из строя, сместиться, вызвать ожог или создать помехи при получении данных.
- Имплантированный кардиостимулятор.
- Кохлеарный имплантат.
- Инсулиновая помпа.
- Металлические клипсы на сосудах.
- Тяжелое состояние.
При наличии таких обстоятельств пациенту рекомендуется проведение КТ малого таза с контрастным усилением.
Относительные противопоказания в большинстве случаев могут быть сняты, они рассматриваются индивидуально. Современные импланты, как правило, не обладают ферромагнитными свойствами и совместимы с МРТ исследованиями.
- Эндопротезы суставов.
- Зубные импланты и протезы.
- Стенты в сосудах.
- Искусственные клапаны в сердце.
- Послеоперационные скобки.
- Кава фильтры.
- Клаустрофобия.
- Вес больше 130 кг.
В последних двух случаях обследование можно провести в томографе открытого типа.
Подготовка
Если планируется МРТ простаты с использованием эндоректального датчика, за 12 часов до процедуры не рекомендуется употреблять тяжелую пищу. Накануне обследования кишечник очищается с помощью клизмы.
Непосредственно перед процедурой необходимо снять с себя все металлические украшения, съемные зубные протезы, одежду с металлическими застежками.
Пациент укладывается на выдвижной стол. В уши вставляются наушники или беруши, так как оборудование во время работы производит громкий шум.
В зависимости от применяемой методики помещается на низ живота или в прямую кишку дополнительная катушка. Стол задвигается внутрь камеры.
Само исследование занимает 20-30 минут. Необходимо максимально сохранять неподвижность. Для связи с лаборантом в камере есть кнопка или микрофон.
Стандартное обследование
Это получение T1 и T2 взвешенных протонных изображений в различных плоскостях. В большинстве случаев дает полную информацию о характере, локализации и распространенности патологического процесса. Для усиления магнитного поля в области малого таза используются дополнительные индукционные катушки:
С контрастированием
Применение контрастного вещества (Гадовист) усиливает разницу между нормальной и патологической тканью.
С динамическим контрастированием
Исследует скорость и характер прохождение контрастного вещества через орган после его внутривенного введения. В злокачественных опухолях происходит ускоренное поглощение и более быстрое «вымывание» по сравнению с неизмененными тканями.
С применением жироподавления
Диффузно-взвешенное изображение (ДВИ). Подвид МРТ обследования, позволяющий получить картину обменных процессов, происходящих на молекулярном уровне. Основывается на определении диффузии молекул воды. В патологических тканях данный процесс происходит не так, как в здоровых. Это дает дополнительную возможность отдифференцировать опухолевый очаг.
В злокачественных новообразованиях плотность клеток выше, чем в нормальной ткани, значит диффузия там уменьшена. Диффузно-взвешенные изображения оцениваются качественно (визуально) и количественно (сопоставляются с картами ИКД — измеряемого коэффициента диффузии).
МР-спектроскопия позволяет оценить биохимический состав тканей.
Мультипараметрическая МРТ(мпМРТ)
Этот метод является сочетанием стандартного T1 и T2 взвешенного изображения в различных плоскостях (саггитальной, аксиальной и фронтальной), динамического контрастирования (DCE), и получения диффузно-взвешенного изображения (DWI).
МпМРТ наиболее рекомендована в диагностике рака простаты. Она позволяет отказаться от биопсии при отсутствии МРТ-данных за злокачественное новообразование, сократить количество инвазивных обследований при выявлении латентных клинически незначимых опухолей.
Как выглядит рак предстательной железы на МРТ
При проведении мпМРТ оцениваются все полученные данные.
- На T1 ВИ хорошо видны лимфатические узлы, кровоизлияния после биопсии, костные структуры.
- Информацию о самой опухоли лучше дает T2 ВИ: РПЖ просматривается как зона со сниженным сигналом с нечеткими контурами на фоне нормальной ткани, видно прорастание опухоли за пределы капсулы железы. РПЖ исходит из периферической зоны в 70-80%, из переходной -10-20%, из центральной зоны – 1-5%.
- Динамическая МРТ с контрастированием (DCE) выявляет увеличение проницаемости сосудов в ткани опухоли, раннее накопление и более быстрое вымывание контраста.
- Диффузно взвешенные изображения: зона ограничения диффузии, яркий сигнал на ДВИ и снижение импульса на картах ИКД.

Pi—RADS (Prostate Imaging Reporting And Data System) — система оценки данных и составления заключения при визуализации простаты. Применяется для расчета вероятности выявления клинически значимого рака. Представляет собой градацию по пятибалльной шкале (1- самая низкая вероятность, 5- самая высокая). Опухоли периферической и переходной зон оцениваются по разным изображениям (периферическая – по ДВИ и ИКД, переходная – по T2 ВИ).
Заключение
Роль магнитно резонансной томографии в диагностике РПЖ возрастает. Она позволяет установить диагноз, отдифференцировать рак от простатита или аденомы, уточнить стадию, выделить клинически значимые формы карцином, избежать ненужных операций и биопсий.
В последних руководствах рекомендована мультипараметрическая МРТ для диагностики РПЖ.
Стоимость обследования колеблется от 4 до 6 тыс. рублей.
Источник rosonco.ru