В данном исследовании рассматривается история болезни пациента с гормонорезистентным метастатическим раком предстательной железы, который безрезультатно прошел традиционные терапии, но затем была достигнута полная ремиссия в результате комбинированного лечения локальной гипертермией (ЛГТ), вирусом болезни Ньюкасла и вакцинацией дендритных клеток (ДК), что являлось нестандартной комбинацией. В августе 2005 года, пациент подвергся радикальной простатэктомии. Вопреки стандартному лечению, у пациента развились прогрессивные метастазы в кости и традиционное лечение было приостановлено в июне 2007 года. Начиная с октября 2007, пациенту начали лечение ЛГТ, онколитическую виротерапию и вакцинацию ДК. Уровень простатического специфического антигена (ПСА), упал с пикового значения 233,8 нг/мл в январе 2008 года, до 0,8 нг/мл в конце февраля 2008 года. В марте 2008 года позитронно-эмиссионная томография (ПЭТ) и компьютерная томография (КТ) выявила сокращение метастазов в костях. С того момента, уровень ПСА оставался низким и пациент чувствовал себя хорошо. Лечение вызвало длительный ответ Т-клеточной противоопухолевой памяти. Возможно, именно это объясняет долгосрочную эффективность нового экспериментального подхода к лечению.
Введение
Рак предстательной железы — самый распространенный вид опухоли у мужчин. Традиционные виды лечения, включая хирургическое вмешательство и лучевую терапию, могут повлечь за собой побочные эффекты, такие как импотенция или недержание, что может сильно ухудшить качество жизни. Для сравнения, направленная иммунотерапия не вызывает серьезных побочных эффектов, так как затрагивает только злокачественные клетки и не влияет на здоровую ткань. Вакцинация дендритных клеток (ДК) это важная часть часть иммунотерапевтической стратегии. Сочетание онколитической виротерапии, гипертермии и иммунотерапии вызывает эффект синергии (высокой совместной эффективности).
Одобрение «Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов» (FDA) первой терапевтической противораковой вакцины — Сипулеуцел-Т, для лечения гормонорезистентного метастатического рака предстательной железы, в апреле 2010 года, положило начало новой эры иммунотерапии. На третьей фазе испытаний, данная вакцина с активированными аутогенными ДК, показала значительное продление жизни пациентов, страдающих от неоперабельного рака предстательной железы. Кроме того, другие многочисленные клинические испытания также показали клиническую эффективность вакцинации ДК.
Другой многообещающий подход заключается в использовании онколитических вирусов нацеленных непосредственно на клетки опухоли. Вирус болезни Ньюкастла (ВБН) — это птичий РНК парамиксовирус, чрезвычайно безопасный для больных онкологическими заболеваниями. Три основных свойства, делающих ВБН подходящим для борьбы с человеческим раком, это репликация исключительно в клетках опухоли, противоопухолевая цитотоксичность и иммуностимуляция.
Гипертермия применяется для лечения широкого круга твердых опухолей. Были разработаны различные техники применения нагрева. Эффект на клеточным уровне включает в себя стимуляцию аптоза и выделение белков теплового шока (БТШ). Также отмечен комбинированный эффект гипертермии совместно с химиотерапией и облучением. Данное исследование докладывает об эффектах комбинирования гипертермии с онколитической виротерапией и иммунотерапией основанной на ДК.
История болезни

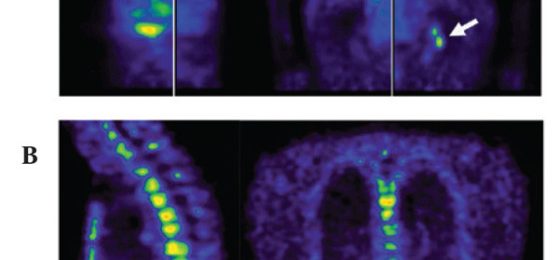
В октябре 2007 года, 75-летний пациент поступил в «Иммунологический и Онкологический Центр» (Кёльн, Германия) с прогрессивным, гормонорезистентным раком предстательной железы, удвоением уровня простатического специфического антигена (ПСА) в течение 65 дней и присутствующими в костях метастазами. Ранее, пациент уже подвергся радикальной простатэктомии в Августе 2005 года, во время первоначальной диагностики. После хирургической операции стадия была pT3b pNX L1 V1 R0, с суммой Глисона 9 (5+4). В сентябре 2005 года, паценту назначена андрогенная депривация Гозерелином (3,6 мг, раз в месяц) и Бикалутамид (50 мг, раз в день), и в январе 2006 года Гозерелин был заменен на Лейпрорелин (10,72 мг, раз в три месяца). Вопреки лечению, в марте 2006 года уровень ПСА пациента возрос и развились метастазы в субакромиальной кости. Опухоль была классифицирована как гормоно-резистентная и андрогенная депривация была прекращена. В период с марта по май 2006 года, пациент подвергся лучевой терапии с дозой 45 Gy (30*1, 5 Gy), что привело к снижению уровня ПСА с 11,6 до 6,5 нг/мл (после простатэктомии, как правило, ПСА не определяется). В период с марта 2006 года по июнь 2007 года, пациенту назначали Кетоконазол (3*400 мг, раз в день) и Гидрокортизон (утренняя доза 20 мг и вечерняя 10мг, ежедневно), в попытке блокировать синтез андргенов надпочечников и яичка. В рамках клинического исследования, экспериментально вводят Октреотид в период с ноября 2006 года по март 2007 года. В связи с повышением уровня ПСА (с 40,8 нг/мл до 60,5 нг/мл), Октреотид был отменен в пользу еще одной попытки с Лейпрорелином (10,72 мг, каждые три месяца) в период с марта по июнь 2007 года. По окончанию андрогенной депривации, было зафиксировано повышение уровня тестостерона (с 0,18 нг/мл в октября 2007 до 6,25 нг/мл в мае 2013; нормальный уровень 2,14-8,27 нг/мл). В апреле 2007 года, сцинтиграфия выявила метастазы в костях двух рёбер и левой части крестца. с июля 2007 года, уровень ПСА возрастал, вероятнее всего из-за прогрессии костных метастазов. В сентябре 2007 года, позитронно-эмиссионная и компьютерная томографии (ПЭТ/КТ) выявили обширное распространения метастазов в костях всего позвоночника, таза, правой плечевой кости и грудной клетки (рис. 1А). В университетском госпитале, в котором пациент проходил лечение, рекомендовали начать химиотерапию, но пациент решил начать иммунотерапию. К октябрю 2007 года, уровень ПСА пациента возрос до 98,1 нг/мл (рис. 2А).
Иммунотерапия
С октября 2007 года по июнь 2008 года, пациент проходил лечение в «Иммунологическом и Онкологическом Центре» (Кёльн, Германия) с локальной гипертермией таза и грудной клетки, а также систематической ВБН виротерапией примерно дважды в неделю. В дополнение, в ноябре 2007 года, пациент прошел 2 сессии локальной гипертермии (ЛГТ) затылка.
В период с ноября 2007 года по март 2008 года, пациент получил 5 вакцин с аутогенными ДК в сочетании с дозированной гипертермии всего тела. С июля по сентябрь 2008 года, лечение пациент проходило при помощи ЛГТ таза и грудной клетки, и онколитической ВБН виротерапии раз в месяц для поддержания иммунного ответа. После сентября 2008 года, было признано отсутствие необходимости дальнейшего иммунотерапевтического лечения.
Гипертермия осуществлялась оборудованием Oncothermia EHY-2000 на радиочастоте 13 МГц. В итоге, пациент прошел 46 процедур гипертермии грудной клетки, 54 процедуры на таз и две на затылок. Длительность сессий была 50 минут каждая, начиная с 60 Ватт и достигая 130 Ватт. Внутривенно вводилось 109 единиц ВБН (штамм MTH-68) каждую сессию.
Итог и следствие
К началу января 2008 года, уровень ПСА достиг своего максимума в 233,8 нг/мл. В конце января и на протяжении февраля, уровень ПСА снизился до 0,8 нг/мл. В марте 2008 года, сокращение метастазов в костях было зафиксировано при помощи ПЭТ/КТ (Рис. 1В). Уровень ПСА сохраняется низким вплоть до сегодняшнего дня и был менее 0,03 нг/мл в декабре 2013 (рис. 2В).

С тех пор возникла устойчивая ремиссия, пациент был протестирован на иммунологический ответ Т-клеточной противоопухолевой памяти. В июле 2011 года был произведен тест методом иммуноферментных пятен (ELISPOT), для определения количества Т-клеток вырабатывающих гамма-интерферон за краткосрочный период (48 ч.) взаимодействия с аутогенными ДК. Всего, в кровообращении, 150±10 на 100 000 Т-клеток продемонстрировали реакцию, но без воздействия ДК, только фоновая реакция в виде 2±1 Т-клеток.
На публикация всех вышеуказанных данных и изображений было получено письменное согласие пациента.
Обсуждение
Первый вывод, который можно сделать исходя из данного исследования, заключается в том что иммунотерапия оказывает сильное влияние на метастатический рак предстательной железы. Описанные процедуры не вызвали соответствующих побочных эффектов. Успешный экспериментальный подход включает в себя комбинацию ЛГТ, онколитической виротерапии и вакцинации ДК. Судя по всему, наблюдаемая иммунологическая память реакции Т-клеток, способствует долгосрочному эффекту лечения.
Второй вывод можно сделать о том, данный случай представляет чрезвычайную важность и актуальность, так-как демонстрирует, что применение иммунотерапии не запрещено на ранних стадиях рака, как полагалось ранее. Результаты были достигнуты новой и научно-обоснованной комбинацией биологических (ВБН и ДК) и физических (ЛГТ) процедур лечения, образующих синергетический эффект. Стратегия не ограничена каким-то определенным видом рака и может иметь широкое применение в клинической онкологии в целом.
В последнее время, традиционные терапии лечения рака предстательной железы, в частности радикальную простатэктамию, ставят под сомнение. Обычно, наличие метастазов должно быть выявлено до простатэктомии. Быстрорастущий после операции уровень ПСА, у описываемого пациента, указывает на наличие метастазов во время хирургического вмешательства. Таким образом, в данном конкретном случае, простатэктомия не только оказалась напрасна, но также привела к постоянному недержанию мочи. Все последующие традиционные терапии не дали положительного эффекта. Кроме описанных процедур иммунотерапии, никакое традиционное или альтернативное лечение не помогло, более того процедуры иммунотерапии не вызвали никаких существенных изменений в образе жизни пациента.
В последующем анализе, изложены причины успешности этого нового подхода к лечению. Во избежание возможных механизмов ухода от иммунитета, включая сдвиг антигена и маскировку опухоли, была применена вакцина ДК со множеством антигенов карциномы предстательной железы, а также были применены две стратегии по введению сигналов опасности в клетки опухоли, включая онколитические вирусы и гипертермию.
ВБН инфекция представляет собой внешнюю вирусную РНК, активируя Толл-подобный рецептор 3, цитоплазматический ген индуцируемый ретиноевой кислотой и белки гемагглютимина-нейраминидазы выраженные в плазменных мембран, что приводит к стимуляции гамма- и бета-интерферона, потенцированию Т-клеточного противоопухолевого иммунитета. Основанием для комбинации вирусной инфекции с гипертермией была ожидаемая синергия, в частности ЛГТ была призвана помочь вирусу в локализации опухоли и репликации. В дополнение, и вирусная инфекция, и гипертермия вызвали реакцию на стресс эндоплазматической сети, изменили выделение БТШ 70/90 и поверхностные свойства клеток опухоли, вызывая иммуногенные механизмы гибели клеток опухоли. Это приводит к поглащению антегена дендритовыми клетками (ДК), кросс-презентации аутологичных антигенов опухоли и стимуляции специфичных Т-клеток. Результатом вакцинации ДК становится еще большая стимуляция и активация Т-клеточного противоопухолевого иммунитета. В идеале, это вызывает эффективную противоопухолевую цитотоксическую реакцию и приводит к длительной противоопухолевой Т-клеточной памяти. Вакцинация ДК была совмещена с умеренной гипертермии всего тела, так-как эффект ДК может быть улучшен повышенными температурами. Спустя более трёх лет после ДК вакцинации, у описываемого пациента была зафиксирована хорошая реакция Т-клеточной противоопухолевой памяти.
Комбинация различных иммунотерапевтических стратегий привела удивительному терапевтическому успеху в случае описываемого пациента. У другого пациента с неоперабельным метастатическим раком предстательной железы, проходившем лечение в «Иммунологическом и Онкологическом Центре», схожая стратегия привела к устойчивой стабилизации болезни на период более чем 4 года. Комбинирование ДК вакцинации, онколитического ВБН и гипертермии представляется эффективным методом и заслуживает дальнейшего изучения.
Исследование частных случаев, таких как случай описанный выше, может выявить важные инновации и пополнить наши знания в области медицины. Частный случай, по утверждению Фармацевтического Закона Германии, имеет важное значение для пациентов и медицинского прогресса.
Авторы: VOLKER SCHIRRMACHER, AKOS‑SIGMUND BIHARI, WILFRIED STÜCKER и TOBIAS SPRENGER
Лечение рака предстательной железы виротерапией
Рак предстательной железы, как и другие виды рака, при благоприятных условиях можно эффективно лечить виротерапией. Но для более детального прогноза — требуются документы из Вашего лечебного заведения. Только изучив результаты анализов, врач-онколог может назначить или наоборот не рекомендовать виротерапию.
Источник viroterapiya.com
Рак предстательной железы (РПЖ) диагностируют у 32 – 40% мужчин старше 50 лет. В половине случаев это локализованный рак, то есть опухоль не выходит за пределы простаты. Стандартом лечения в такой ситуации считается радикальная простатэктомия – одномоментное удаление новообразования. Не уступает по радикальности и лучевая терапия, которую часто рассматривают как альтернативу операции. Тем не менее, лечение не всегда эффективно. Иногда болезнь возвращается спустя несколько месяцев или лет после радикального лечения. Такое состояние называется рецидивом рака предстательной железы, который может быть локальным или местным, системным и биохимическим.
Вероятность рецидива после радикальной простатэктомии составляет от 10 до 28% в первые 5 лет после вмешательства. Это зависит от строения опухоли, соматического состояния пациента, размера новообразования. Например, если радикальную простатэктомию выполняли на стадии T3а (рак распространяется на клетчатку вокруг простаты), вероятность возрастает до 45%.

Развитие рецидива в течение 5 лет после лучевой терапии составляет 12 – 38%. При этом будут иметь значение не только особенности новообразования, но и доза облучения – чем она меньше, тем выше риски. Вид воздействия (брахитерапия или дистанционное) большой роли не играет.
Если же говорить о сроках в целом, 45% случаев регистрируются в течение 2 лет после радикального лечения, 77% – в пределах 5 лет, 96% – на протяжении 9 лет.
Биохимический рецидив
Протекает бессимптомно и определяется исключительно по результатам анализа на уровень простатспецифического антигена (ПСА или PSA). Это особый белок, который есть только в тканях предстательной железы. Соответственно, после ее удаления, уровень простатспецифического антигена должен резко снизиться до значений, не определяемых стандартными методами исследований. Если же, спустя некоторое время, уровень ПСА начинает вновь возрастать, это может означать лишь то, что в организме остались клетки опухоли, которые начали размножаться. Биохимический рецидив после радикальной простатэктомии диагностируют, когда уровень ПСА систематически увеличивается через три измерения подряд на 0,2 нг/мл и более, интервал между исследованиями больше или равен 2 неделям.
Подобная ситуация возможна и после радиотерапии. Конечно, при облучении часть тканей железы остается жизнеспособной и уровень ПСА не опускается до неопределяемых значений. Поэтому за исходную точку берут самый низкий уровень антигена.
Критерием биохимического рецидива считается повышение показателя PSA более чем на 2 нг/мл по сравнению с минимальным значением, отмечавшимся у больного.
Биохимический рецидив рака предстательной железы лечат облучением ложа простаты, иногда вместе с захватом области регионарных лимфоузлов.
Локальный рецидив
Локальный рецидив рака простаты после радикальной простатэктомии регистрируется в 15 – 35% случаев. Местным — считается появление очага опухоли в области расположения удаленной предстательной железы при отсутствии поражения лимфоузлов и отдаленных метастазов. Этот очаг должен быть визуализирован, то есть виден на УЗИ, компьютерной томограмме, при МРТ-обследовании или ПЭТ — КТ. Его злокачественность должна подтверждаться гистологически – то есть после взятия биопсии и исследования под микроскопом.
Клинических симптомов на ранней стадии обычно не бывает. Чаще всего во время очередного профилактического обследования у пациента обнаруживают вновь повысившийся уровень ПСА, после чего проводят углубленную диагностику и выявляют местный рост опухоли. Если пациент, вопреки рекомендациям, не обследуется профилактически после радикального лечения и рецидив на ранних стадиях не выявлен, на поздних этапах развития возвращаются некоторые симптомы запущенных стадий рака простаты: боли в промежности и над лобком, задержка мочи, запоры.
Лечение локального рецидива РПЖ зависит от того, какой метод был использован ранее.
Если первично возникший рак лечили с помощью лучевой терапии, при рецидиве выполняют радикальную простатэктомию (РПЭ). При этом вероятность послеоперационных осложнений выше, чем если бы хирургическое вмешательство было сделано при первичном раке: после облучения возрастает опасность повреждения прямой кишки, увеличивается кровопотеря во время вмешательства, высок риск возникновения недержания мочи, или, наоборот, контрактуры (патологического сокращения) шейки мочевого пузыря. 5-летняя безрецидивная выживаемость после операции 55 – 69%.
Если же первично была выполнена РПЭ, при лечении рецидива рака используют лучевую терапию. 5-летняя безрецидивная выживаемость при этом зависит от исходного уровня ПСА. Если он меньше 0,2 нг/мл, показатель 5-летней безрецидивной выживаемости достигает 77%, при 0,2 нг/мл опускается до 34%, а если уровень ПСА доходит до 1 нг/мл, прогноз расценивается как неблагоприятный.
Из экспериментальных методов, достоверной статистики эффективности которых пока нет, применяется криоабляция (замораживание) и воздействие сфокусированным ультразвуком высокой интенсивности (HIFU-терапия). Несмотря на то, что предварительные результаты исследований эффективности методик довольно обнадеживающие, в официальные гайдлайны эти манипуляции пока не включены.
Системный рецидив
Случается и так, что на момент радикального лечения остались недиагностированные микрометастазы, которые продолжили свое развитие после вмешательства. В этом случае трудно отличить системный рецидив (возобновление роста новообразования) от системной прогрессии опухоли (продолжения развития не удаленных очагов).
Отчасти, их можно различить по следующим критериям:
- повышение концентрации ПСА менее чем через год после операции;
- уровень ПСА удваивается за 4 – 6 месяцев;
- 8 – 10 баллов по шкале Глисона.
Системный рецидив клинически проявляется такими же симптомами, как и метастатический рак. Поскольку злокачественные новообразования предстательной железы метастазируют в кости, легкие, печень, возникают признаки поражения этих органов:
- боли в костях;
- патологические переломы;
- повышенный уровень кальция и щелочной фосфатазы крови;
- боли в позвоночнике;
- парезы, параличи (при сдавлении спинного мозга);
- боли в подреберье;
- увеличение печени;
- анемия.
Эти проявления сопровождаются общим недомоганием, повышением температуры до 37-38, потерей аппетита, резким снижением массы тела.
При системном рецидиве, равно как и при прогрессии рака предстательной железы применяют гормонотерапию, чаще всего – кастрацию.
Метастазы в кости подвергаются радиотерапии – облучение помогает уменьшить интенсивность болевого синдрома.
Источник rosonco.ru
 Прогноз в онкологии – клинически подкрепленное предположение о последующем развитии и исходе заболевания. Он может быть благоприятным, когда ожидается полное выздоровление пациента и неблагоприятным, предполагающим неполное выздоровление или смерть.
Прогноз в онкологии – клинически подкрепленное предположение о последующем развитии и исходе заболевания. Он может быть благоприятным, когда ожидается полное выздоровление пациента и неблагоприятным, предполагающим неполное выздоровление или смерть.
Основным количественным параметром, которым оперируют врачи при пронозировании онкопатологии, является показатель выживаемости, определяющий продолжительность жизни пациента с тем или иным типом и стадией рака от момента его диагностирования. Показатель выживаемости не определяет, сколько проживет пациент, а используется для более точного прогнозирования исхода заболевания и определения вероятности успешности проводимого лечения рака в Израиле. В онкоцентре Ихилов прогноз при раке простаты является открытой информацией и может доводиться до пациента и его родственников.
Навигация по статье
Показатель выживаемости при раке простаты
 В онкологии стандартом является 5-летний показатель выживаемост и, показывающий процентную долю людей, которые живут, по меньшей мере, пять лет от момента диагностирования онкопатологии. Он не используется для определения продолжительности жизни, т.к. многие пациенты с раком предстательной железы живут гораздо дольше пяти лет, а является сравнительной характеристикой, сопоставляющей статистику по онкобольным с данными по общей популяции. При этом следует понимать, что показатель выживаемости – величина относительная, и что прогноз будет основываться в первую очередь на конкретной информации, полученной в ходе проведения диагностических мероприятий.
В онкологии стандартом является 5-летний показатель выживаемост и, показывающий процентную долю людей, которые живут, по меньшей мере, пять лет от момента диагностирования онкопатологии. Он не используется для определения продолжительности жизни, т.к. многие пациенты с раком предстательной железы живут гораздо дольше пяти лет, а является сравнительной характеристикой, сопоставляющей статистику по онкобольным с данными по общей популяции. При этом следует понимать, что показатель выживаемости – величина относительная, и что прогноз будет основываться в первую очередь на конкретной информации, полученной в ходе проведения диагностических мероприятий.
От чего зависит прогноз при раке простаты
 Важнейшим фактором, определяющим прогноз рака простаты, является диагностирование заболевания на ранней стадии. Существует два основополагающих критерия для прогнозирования:
Важнейшим фактором, определяющим прогноз рака простаты, является диагностирование заболевания на ранней стадии. Существует два основополагающих критерия для прогнозирования:
- степень злокачественности опухоли
- стадия заболевания
Степень злокачественности опухоли показывает ее агрессивность и определяется по шкале Глиссона от 1 до 5. Система Глиссона основана на микроскопическом исследовании фрагмента предстательной железы и сравнении раковых клеток с нормальными клетками: при минимальном их отличии опухоли присваивают 1 балл, при максимальном – 5. Обычно исследуют два образца ткани, взятых из разных участков железы, после чего суммируют их показатели по шкале Глиссона:
- 6 и менее баллов – хорошо дифференцированная и неагрессивная опухоль;
- 8-10 баллов – низкодифференцированная и агрессивная опухоль;
Стадия заболевания определяется распространенностью опухоли. Чаще всего рак предстательной железы распространяется в паховые лимфоузлы и кости. В онкоцентре Ихилов используется современное оборудование, позволяющее диагностировать рак на ранней стадии еще до того, как он начал метастазировать в удаленные органы и ткани, что значительно улучшает прогноз.
Прогноз при раке простаты
5-летний показатель выживаемости для нераспространенной онкопатологии простаты, когда новообразование локализовано в пределах железы (рак 1 и 2 стадии), приближается к 100%. В 90% случаев заболевание диагностируется именно на этом этапе своего развития.
Распространенный рак, который проник в удаленные лимфоузлы, кости и другие органы, тяжелее всего поддается лечению. 5-летний показатель выживаемости в этом случае будет составлять 26%.
Следует иметь в виду, что эти показатели носят оценочный характер и не могут быть использованы в прогнозировании конкретных клинических случаев. Даже для 4 стадии заболевания существуют терапевтические опции, которые могут значительно продлить жизнь пациента. Материально-техническая база и кадровые ресурсы онкоцентра Ихилов (Москва) позволяют успешно решать самые сложные задачи.
Выживаемость на 4 стадии рака простаты
На терминальной стадии рака предстательной железы около половины пациентов живут не более двух лет . Наихудшим вариантом для 4 стадии онкопатологии предстательной железы является кастрационно-резистентный рак, когда опухоль больше не реагирует на гормональную терапию.
Однако в последние годы с появлением ряда новых препаратов (т.н. «суперблокаторы тестостерона») продолжительность жизни таких пациентов показывает тенденцию к увеличению. Отягощающим фактором, влияющим на выживаемость, является наличие сопутствующих заболеваний – кардиоваскулярной патологии, сахарного диабета. По мере развития опухоли, она начинает серьезно влиять на функцию почек, препятствуя оттоку мочи из мочевого пузыря. Это обстоятельство также в значительной степени влияет на прогнозирование.
Инновации в прогнозе рака простаты
Первым опухолевым маркером в онкологии в далеком 1939 году стала щелочная фосфатаза, которая, наряду с ПСА, длительное время использовалась для диагностики онкопатологии предстательной железы. Однако в последние годы появилось несколько новых тестов, позволяющих более точно прогнозировать течение и возможный исход заболевания:
- определение Индекса здоровья простаты (соотношение общего ПСА к свободному ПСА). Используется для определения степени злокачественности опухоли при нормальном ПСА;
- ПСА-3 тест. С его помощью определяются раковые клетки в моче, что помогает выявить карциному предстательной железы на ранней стадии;
- MDx-тест. Определяет рак по метилированным ДНК нормальных клеток, окружающих опухоль;
- OncotypeDX, Prolaris и Decipher
Прогноз рекуррентного рака простаты
 Рак предстательной железы ежегодно диагностируется у 900 000 мужчин по всему миру. В 90% случаев заболевание выявляется на ранней стадии, когда опухоль локализована в пределах простаты. Лечение таких пациентов, как правило, проходит успешно, и рак удается победить. Однако в ряде случаев отмечается рецидивирование опухоли. Вероятность такого развития событий зависит от ряда факторов, в т.ч. уровня ПСА, стадии заболевания, степени злокачественности опухоли, определяемой по шкале Глисона.
Рак предстательной железы ежегодно диагностируется у 900 000 мужчин по всему миру. В 90% случаев заболевание выявляется на ранней стадии, когда опухоль локализована в пределах простаты. Лечение таких пациентов, как правило, проходит успешно, и рак удается победить. Однако в ряде случаев отмечается рецидивирование опухоли. Вероятность такого развития событий зависит от ряда факторов, в т.ч. уровня ПСА, стадии заболевания, степени злокачественности опухоли, определяемой по шкале Глисона.
Например, у пациента с 2-3 стадией рака, высоким ПСА и высокими показателями по шкале Глисона будет наихудший прогноз и наивысшая вероятность рецидивирования рака после периода ремиссии. От этих же факторов будут зависеть и терапевтические опции при рекуррентном раке: например, у пациентов с локализованным раком может быть использовано органосохраняющее хирургическое вмешательство, в то время как у лица с распространенной опухолью будут кандидатами для системных методов лечения, например, гормональной терапии.
Фактор отягощенного анамнеза
Лица с отягощенной наследственностью, в семьях которых были случаи онкопатологии предстательной железы (у братьев, отцов, дедов) по достижению ими 40 лет должны подвергаться ежегодному скринингу, включающему ректальное пальпирование и анализ крови на ПСА. Данная мера позволит оценить исходное состояние предстательной железы пациента, динамику возможных изменений и оперативно отреагировать на резкие скачки уровня ПСА в крови.
Регулярный скрининг злокачественных заболеваний простаты значительно повышает вероятность благоприятного исхода: так, за годы его проведения, смертность от этого заболевания снизалась почти на 40%. Диагностика в онкоцентре Ихилов (Москва) – это возможность выявить рак на самых ранних стадиях развития патологического процесса, что обеспечивает максимально высокие показатели выживаемости и снижает вероятность рецидивирования опухоли после проведенного лечения.
Стоимость лечения рака простаты в Израиле
Ниже будет приведена таблица, в которой вы найдете цены некоторых видов диагностики и лечения рака простаты в онкоцентре Ихилов.
Источник oncocenter-ichilov.com