Рак предстательной железы (РПЖ) все больше привлекает внимание онкологов. Заболеваемость им стремительно растет, особенно среди пожилых мужчин. Эта локализация рака занимает 2–3 место по частоте среди впервые выявляемых онкологических диагнозов в развитых странах.
По причинам смертности у мужчин РПЖ – на втором месте после рака легкого. Несмотря на внедряемый скрининг, около 50% впервые установленных карцином простаты — это третья и четвертая стадия.
РПЖ, выявленный на ранней стадии, в 90% полностью излечивается, что обуславливает необходимость своевременного обследования.
Диагностика рака предстательной железы: группа риска
Мужчины старше 50 лет должны помнить об этом заболевании. Посетить врача рекомендуется при наличии следующих симптомов:
- учащенное мочеиспускание, особенно подозрительны подъемы в туалет в ночное время; затруднение акта мочеиспускания;
- изменения самого процесса мочеиспускания: ослабление или разбрызгивание струи, чувство неудовлетворенности после посещения туалета, неполное опорожнение пузыря;
- ослабление потенции; примесь крови в сперме или моче.
Симптомы эти неспецифические, они встречаются и при доброкачественной гиперплазии, которая также выявляется после 50-60 лет. Тем не менее риск заболеть раком ПЖ присутствует у трети мужчин пожилого возраста.
Проверяться должны мужчины и без признаков патологии, так как на раннем этапе развития РПЖ может никак себя не проявлять. Рекомендовано проходить осмотр у уролога лицам старше 50 лет 1 раз в 2 года.
Люди, кровные родственники которых больны РПЖ, более подвержены развитию карциномы, т.к. предрасполагающая наследственность является фактором риска развития этой опухоли. Шанс заболеть раком ПЖ в 2–3 раза выше у мужчин, у кого в семье по мужской линии (отец, брат) установлен данный диагноз. Если же РПЖ диагностирован у двух родственников, риск увеличивается до 8 раз.
Скрининг
Скринингом называется массовое обследование лиц группы риска с целью выявления бессимптомной патологии. Так как рак простаты на начальных этапах чаще всего не проявляется, очень важно найти методы его раннего выявления.
В отношении РПЖ скринингом считается пальцевое исследование простаты и определение показателя ПСА (простатспецифического антигена) в крови.
В существующем, на настоящий момент, в России порядке прохождения диспансеризации взрослого населения предусмотрено определение общего ПСА в возрасте 45 и 51 года. При выявлении отклонений от нормы – консультация хирурга или уролога. Сроки, периодичность и обязательность обследования для всех мужчин в настоящее время пересматриваются. Скрининг имеет свои недостатки, многие ученые высказываются за добровольное и индивидуальное принятие решения в этом вопросе.
Пальцевое ректальное исследование (ПРИ)
Простата хорошо прощупывается через стенку прямой кишки. Метод простой, доступный, проводят его как урологи, так и обычные хирурги. Но таким способом выявляются только опухоли, расположенные в задней периферической зоне.
В норме железа эластической консистенции, размером примерно с грецкий орех, податлива при надавливании, симметрична, с ровными контурами. Слизистая прямой кишки над ней подвижна.
При пальпации врач обращает внимание на:
- очаговые образования (бугристость поверхности);
- асимметрию железы; нечеткость контуров;
- неподвижность простаты при давлении на нее;
- наличие тяжей инфильтрата по верхнему краю железы;
- в запущенных случаях – большая опухоль, очень плотной консистенции, далеко выступающая в просвет кишки.
Наличие хотя бы одного пальпируемого признака должно стать сигналом к дальнейшему обследованию. Однако этот метод мало информативен и не подходит для скрининга. Эффективность ранней диагностики рака предстательной железы при пальпации через прямую кишку не превышает 4%.
Лабораторные критерии
- Общий анализ крови. На начальных этапах — неинформативен, т.к. показатели остаются в пределах референтных значений. На поздних стадиях определяется анемия, лейкоцитоз, увеличение СОЭ.
- Анализ мочи – возможна макро- и микрогематурия (наличие крови), протеинурия(белок в моче), определение избыточного количества лейкоцитов.
- Уровень ПСА.
ПСА как маркер диагностики РПЖ
ПСА – гликопротеин, вырабатываемый секреторным эпителием простаты. Это тканевой белок, его количество повышается в крови не только при карциномах, но и при доброкачественной аденоме и хронических воспалительных процессах. Различные манипуляции (массаж простаты, катетеризация мочевого пузыря, пальцевое ректальное исследование) увеличивают концентрацию ПСА на несколько дней, а инвазивные вмешательства (биопсия, трансуретральная резекция) – на несколько недель. На этот анализ может влиять прием алкоголя и предшествующий половой акт.
Средним нормальным считается уровень 2,5 нг/мл. С возрастом референтные значения расширяются. У лиц старше 70 лет содержание ПСА до 6,5 нг/мл не считается патологией.
ПСА в крови находится как в свободном, так и в связанном с белками состоянии. Сумма этих двух фракций и составляет цифру общего ПСА.
Считается, что повышение данного показателя до 10 нг/мл чаще связано с ДГПЖ, а при цифре > 10 нг/мл – более вероятен РПЖ. В целом чем выше уровень ПСА, тем чаще выявляется карцинома простаты. В то же время у 13% мужчин с верифицированной карциномой уровень ПСА был в норме.
Однократное впервые выявленное повышение этого показателя не является поводом к немедленной биопсии. ПСА повторяют в динамике, через несколько недель, в отсутствии провоцирующих его повышение факторов, иногда – после курса антибактериальной терапии. Имеет значение также скорость прироста уровня ПСА – вероятность наличия РПЖ возрастает при увеличении этого показателя > 1 нг/мл за год.
Индекс здоровья простаты
Актуальная практическая задача — изучение способа повышения специфичности маркеров РПЖ. В рекомендации по диагностике рака простаты на ранней стадии введено понятие индекса здоровья простаты (PHI-Prostate health index). Его используют для принятия решения о целесообразности выполнения биопсии в сомнительных ситуациях, когда при ректальном исследовании не выявляется патология, а показатель общего ПСА определяется в «серой зоне» от 2,5 до 10 нг/мл.
PHI складывается из количественного определения общего, свободного ПСА и 2проПСА и их соотношения. Эти три величины объединены расчетной формулой. Чем выше индекс, тем больше вероятность обнаружения злокачественного процесса, и тем четче показания для биопсии. Пороговым значением PHI считается 25.
В конце прошлого века был обнаружен РСА3 (Prostate Cancer Antigen 3). Это новый биомаркер, он более специфичен, чем общий и свободный ПСА, так как присутствует только в злокачественных клетках и не зависит от наличия доброкачественной аденомы, простатита, возраста.
Сейчас PCA3 повсеместно внедряется в практику. Выявляют его в моче, полученной после массажа предстательной железы. Анализ на РСА3 позволяет избежать ненужных биопсий.
Трансректальное ультразвуковое исследование (ТРУЗИ)
После очистительной клизмы в прямую кишку вводится ультразвуковой датчик. Таким образом, он будет максимально приближен к предстательной железе.
УЗИ картина рака простаты
Абсолютные признаки опухоли – это собственно визуализация очагового образования. Злокачественный узел чаще локализуется в одной доле органа, реже встречается двустороннее поражение.
Рак предстательной железы на УЗИ визуализируется как неправильной формы очаг с нечеткими краями, структура его – преимущественно гипоэхогенная с гиперэхогенными включениями.
В 1/3 случаев ТРУЗИ не визуализирует прямых признаков опухоли. Необходимо обращать внимание и на косвенные изменения: неровность поверхности железы, нарушение целостности капсулы, нечеткость контуров семенных пузырьков.
Биопсия
Это взятие ткани для микроскопического исследования. Является «золотым стандартом» в диагностике РПЖ. Она назначается при подозрении на опухоль по одному из трех базисных методов диагностики: пальцевом ректальном исследовании, ТРУЗИ и повышению (неоднократному) уровня ПСА.

Биопсия простаты проводится под местной анестезией под контролем трансректального УЗИ. Забор материала осуществляют толстой иглой, в который набирают столбик ткани высотой 15-20 мм.
Пункцию производят из 8-12 участков. Чем больше объем простаты, тем больше должно быть биопсийных точек.
Материал исследуется для определения наличия злокачественных клеток, гистологического типа опухоли, а также степени агрессивности по шкале Глисона.
Данная шкала применима для аденокарцином, как наиболее распространенного типа опухолей ПЖ и включает в себя 5 степеней дифференцировки злокачественных клеток, пронумерованные соответственно по баллам от 1 до 5. Чем выше показатель, тем более низкодифференцированными клетками (а значит и более злокачественной опухолью) представлен образец.
Индекс Глисона – это сумма двух наиболее распространенных баллов в исследуемых биоптатах. Соответственно он может быть от 2 до 10. Эта цифра представляет прогностическую ценность, так как помогает предсказать скорость распространения рака, метастазирования, общую выживаемость, а также влияет на выбор тактики лечения.
| Индекс шкалы Глисона | Агрессивность рака |
| 2-4 | Низкая |
| 5-6 | Умеренная |
| 7 | Средняя |
| 8-10 | Высокая |
Если первичная биопсия не дала положительных результатов, а подозрения на наличие РПЖ сохраняются, выполняется повторная манипуляция. Особенно она показана при выявлении атипии и неоплазии в трех и более первично взятых биоптатов.
ТУР (трансуретральная резекция) не рекомендуется как целенаправленная процедура для диагностики рака простаты. Но резецированная ткань при проведении этой операции по поводу ДГПЖ обязательно направляется на гистологическое исследование и вполне может стать источником обнаружения злокачественных клеток.
Магнитно-резонансная томография (МРТ) малого таза
Данный метод позволяет определить размеры, распространенность опухоли, прорастание капсулы железы, поражение регионарных лимфоузлов и семенных пузырьков. На МРТ хорошо видны передние отделы простаты, которые недоступны пальпации через стенку прямой кишки и не всегда просматриваются при ТРУЗИ.
Определить стадию заболевания на дооперационном этапе можно только после МРТ. Это обследование обязательно при сумме Глисона > 7 и высоком уровне ПСА (> 20 нг/мл).
Компьютерная томография (КТ)
Преследует те же цели, что и МРТ, но считается менее информативной. Назначается при наличии противопоказаний к МРТ, а также при планировании лучевой терапии.
Для усиления результативности используется дополнительное контрастирование.
Лимфаденэктомия
Это операция, направленная на удаление тазовых лимфоузлов для уточнения их поражения. Проводится при планировании местного радикального лечения РПЖ в тех случаях, когда методы визуализации оставляют сомнения в наличии регионарных метастазов.
ПЭТ КТ (позитронно-эмиссионная компьютерная томография)
Новейший метод радионуклидной и лучевой диагностики. Основные преимущества:
- Четкое установление первичного очага и распространенности его.
- Можно «просмотреть» сразу весь организм и визуаилизировать все метастазы (как местные, так и отдаленные).
- Информативность выше, чем у других методов визуализации. Обследование не инвазивно и безболезненно.
- Дает возможность контролировать результаты лечения.
В качестве радиоактивного маркера (или трейсера) используется холин-С11 или F18.
ПЭТ КТ не является пока рутинным методом исследования в силу своей малодоступности и высокой цены. Но в некоторых ситуациях она рекомендуется пациенту для выявления генерализации процесса.
Источник rosonco.ru
Нет комментариев admin | Ноя 9, 2015 | УЗИ простаты |
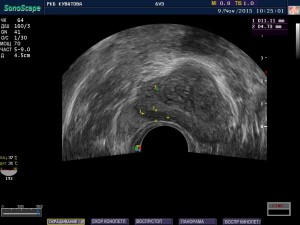 В настоящее время рак предстательной железы самое распространенное заболевание среди других раков. Это заболевание характеризуется поражением предстательной железы в виде мелких очагов, недоступных для визуализации при трансабдоминальном обследовании предстательной железы. Пациент зачастую не предъявляет каких либо жалоб при имеющемся уже заболевании. Чаще всего рак простаты выявляется при медосмотрах при сдаче анализа на ПСА(онкомаркер) — при его повышении (норма 0-4 нг/мл) пациента направляют на дообследование (прохождение ТРУЗИ). При ТРУЗИ выявляются специфические изменения, характерные только для рака простаты. И так, при оценке ультразвуковой картины предстательной железы мы обращаем внимание на периферическую зону, где чаще всего локализуются подозрительные очаги. Данные очаги бывают чаще всего сниженной эхогенности, с неровными нечеткими контурами, в режиме цветового доплеровского картирования отмечается кровоток в толще либо по контуру подозрительного образования. Кроме таких специфических признаков рака простаты, есть и неспецифические признаки. Расположение патологических очагов в переходных зонах, в зоне периуретральных желез или просто диффузные изменения, напоминающие очаги. Даже при наличии подозрительного очага, и при низком уровне анализа ПСА, рекомендовано динамическое наблюдение в течении 3-4 месяца. Возрастные нормы анализа ПСА: 40-49 лет — 2,5 нг/мл, 50-59 лет — 3,5 нг/мл, 60-69 лет — 4,5 нг/мл, более 70 лет — 6,5 нг/мл. При подозрении на рак простаты, проводится прицельная биопсия предстательной железы под УЗ контролем. И в завершении могу сказать что прохождение данного исследования очень информативно в диагностике рака простаты. Данное обследование необходимо проводить ежегодно, при контроле уровня ПСА крови. Это будет отличный способ заподозрить рак простаты на самых ранних этапах его развития.
В настоящее время рак предстательной железы самое распространенное заболевание среди других раков. Это заболевание характеризуется поражением предстательной железы в виде мелких очагов, недоступных для визуализации при трансабдоминальном обследовании предстательной железы. Пациент зачастую не предъявляет каких либо жалоб при имеющемся уже заболевании. Чаще всего рак простаты выявляется при медосмотрах при сдаче анализа на ПСА(онкомаркер) — при его повышении (норма 0-4 нг/мл) пациента направляют на дообследование (прохождение ТРУЗИ). При ТРУЗИ выявляются специфические изменения, характерные только для рака простаты. И так, при оценке ультразвуковой картины предстательной железы мы обращаем внимание на периферическую зону, где чаще всего локализуются подозрительные очаги. Данные очаги бывают чаще всего сниженной эхогенности, с неровными нечеткими контурами, в режиме цветового доплеровского картирования отмечается кровоток в толще либо по контуру подозрительного образования. Кроме таких специфических признаков рака простаты, есть и неспецифические признаки. Расположение патологических очагов в переходных зонах, в зоне периуретральных желез или просто диффузные изменения, напоминающие очаги. Даже при наличии подозрительного очага, и при низком уровне анализа ПСА, рекомендовано динамическое наблюдение в течении 3-4 месяца. Возрастные нормы анализа ПСА: 40-49 лет — 2,5 нг/мл, 50-59 лет — 3,5 нг/мл, 60-69 лет — 4,5 нг/мл, более 70 лет — 6,5 нг/мл. При подозрении на рак простаты, проводится прицельная биопсия предстательной железы под УЗ контролем. И в завершении могу сказать что прохождение данного исследования очень информативно в диагностике рака простаты. Данное обследование необходимо проводить ежегодно, при контроле уровня ПСА крови. Это будет отличный способ заподозрить рак простаты на самых ранних этапах его развития.
«ЛУЧШЕ РАННЯЯ ДИАГНОСТИКА, ЧЕМ ПОЗДНЕЕ ЛЕЧЕНИЕ. »
Источник uzi-v-ufe.ru
Диагностика рака простаты, как правило, включает:
- пальцевое ректальное исследование (ПРИ);
- определение концентрации простатспецифического антигена (ПСА) в сыворотке крови;
- трансректальное ультразвуковое исследование (ТРУЗИ);
- магнито-резонансную томографию органов малого таза (МРТ малого таза) с контрастированием;
- пункционную биопсию предстательной железы с гистологическим исследованием.
Диагноз подтверждается при обнаружении клеток аденокарциномы в биопсийном или послеоперационном материале ткани предстательной железы (например, после ТУР простаты).
Пальцевое ректальное исследование.
Большинство новообразований предстательной железы локализуются в ее периферической зоне, и могут быть выявлены при пальцевом ректальном исследовании, если их объем достигает 0,2 см. куб. и более. Выявление подозрительных уплотнений с помощью пальцевого ректального исследования является абсолютным показанием для проведения биопсии предстательной железы.
Примерно у 18% всех больных раком предстательной железы заболевание выявляется только по подозрительным участкам, обнаруженным при пальцевом ректальном исследовании независимо от уровня ПСА. Выявление подозрительных участков при пальцевом ректальном исследовании у больных с уровнем ПСА
Диагностика рака простаты кардинально улучшилась с введением анализа на уровень простатического специфического антигена (ПСА). ПСА является протеазой сыворотки крови, которая вырабатывается преимущественно эпителиальными клетками предстательной железы. Для практических целей можно сказать, что он органоспецифический, однако не является специфическим для рака. Поэтому его уровень в сыворотке крови может быть повышенным при доброкачественной гиперплазии предстательной железы (ДГПЖ), простатите и других незлокачественных заболеваниях простаты.
Повышенный уровень ПСА при определении показаний к биопсии является более достоверным прогностическим фактором рака, чем выявление подозрительных участков методом пальцевого ректального исследования и ТРУЗИ.
Недавнее исследование по профилактике рака предстательной железы, проведенное в США, подтвердило данные о том, что у многих мужчин рак предстательной железы может присутствовать несмотря на низкий уровень ПСА в сыворотке крови. Ниже представлено соотношение между вероятным наличием рака предстательной железы и уровнем ПСА в сывортоке крови у 2950 мужчин.
Риск рака предстательной железы при низком уровне ПСА.
Уровень ПСА, нг/мл
Риск рака предстательной железы
Соотношение свободного и общего ПСА.
Соотношение свободный/общий ПСА является наиболее исследованным и широко используемым в клинической практике критерием для дифференциальной диагностики доброкачественной гиперплазии предстательной железы и рака предстательной железы. Этот показатель позволяет определить степень риска наличия рака предстательной железы у мужчин с уровнем общего ПСА от 4 до 10 нг/мл и отрицательным результатом пальцевого ректального исследования. В ходе проспективного многоцентрового исследования рак предстательной железы был выявлен при биопсии у 56% мужчин с соотношением свободный/общий ПСА 0,25.
Скорость прироста ПСА и время удвоения ПСА.
Существует два способа оценки изменений ПСА во времени:
• скорость прироста ПСА, которая определяется как абсолютный ежегодный прирост ПСА в сыворотке крови (нг/мл/год);
• время удвоения ПСА, которое выражает экспоненциальное увеличение ПСА в сыворотке крови с течением времени, отражая относительные изменения.
Эти два критерия могут иметь прогностическую ценность у пациентов, прошедших лечение по поводу рака предстательной железы. Тем не менее, их использование в диагностике рака простаты ограничено из-за влияния сопутствующих состояний (большой объем предстательной железы, хронический простатит), неодинаковых интервалов между измерениями ПСА и увеличения/снижения скорости и времени удвоения ПСА с течением времени.
Трансректальное ультразвуковое исследование (ТРУЗИ).

Далеко не всегда при ТРУЗИ можно увидеть классическое изображение гипоэхогенного участка в периферической зоне предстательной железы, характерное для рака предстательной железы. ТРУЗИ в режиме серой шкалы не позволяет определить рак предстательной железы с достаточной достоверностью.
Поэтому прицельная биопсия предполагаемых пораженных участков не является эффективной заменой систематической биопсии (т.е. биопсии из 12-18 точек). Однако дополнительная биопсия предполагаемых пораженных участков под контролем ТРУЗИ может оказаться полезной.
Биопсия при раке предстательной железы.
Первичная биопсия предстательной железы.
Показаниями для назначения биопсии предстательной железы являются повышенный (более 4 нг/мл) уровень ПСА и/или подозрительные участки, выявленные во время пальцевом ректальном исследовании или ТРУЗИ.
Высокий уровень ПСА, выявленный при однократном исследовании, не является прямым показанием к биопсии. Необходимо повторно определить уровень ПСА через несколько недель при помощи того же анализа в стандартных условиях (т.е. без эякуляции и без манипуляций, таких как катетеризация, цистоскопия или трансуретная резекция – ТУР, и при отсутствии инфекций мочевых путей) в той же диагностической лаборатории с использованием тех же методов.
В настоящее время проведение биопсии предстательной железы под контролем ультразвука является стандартным методом диагностики. Хотя при биопсии предстательной железы используется преимущественно трансректальный способ, некоторые урологи производят ее трансперинеально. Частота обнаружения рака при помощи трансперинеальной биопсии предстательной железы сопоставима с частотой обнаружения при трансректальной биопсии. Трансперинеальный способ под контролем ультразвука является полезной альтернативой в особых случаях, например, у больных после экстирпации прямой кишки.
Повторная биопсия предстательной железы.
Показаниями для назначения повторной биопсии предстательной железы являются:
• увеличивающийся или стабильно высокий уровень ПСА, подозрительные участки, выявленные при пальцевом ректальном исследовании;
• атипичная мелкоацинарная пролиферация.
Оптимальный срок проведения повторной биопсии не установлен. Его определяют на основании результатов патоморфологического исследования при первичной биопсии с учетом серьезности подозрений на рак предстательной железы (атипичная мелкоацинарная пролиферация, высокий или быстро растущий уровень ПСА, подозрительные уплотнения при пальцевом ректальном исследовании, семейный анамнез).
Чем позднее проводится повторная биопсия,тем выше частота обнаружения рака предстательной железы. Наличие ПИН высокой степени, без дополнительных исследований, больше не рассматривают в качестве показания к повторной биопсии.
Таким образом, направление на повторную биопсию предстательной железы следует выдавать на основании других клинических критериев, например, результатов пальцевого ректального исследования и уровня ПСА.
При наличии множественных очагов ПИН (выявленной в нескольких биоптатах), возможно, есть основания для ранней повторной биопсии предстательной железы, так как в таком случае риск развития рака предстательной железы несколько повышается.
Сатурационная биопсия предстательной железы.
Частота выявления рака предстательной железы при помощи повторной сатурационной биопсии, варьируется от 30 до 43% и зависит от количества столбиков, полученных при предыдущих биопсийных исследованиях.
В особых случаях сатурационную биопсию можно выполнять трансперинеально. Это позволяет выявить дополнительно рак предстательной железы в 38% случаев. Однако недостатком этого способа (3-D стереотаксическая биопсия из 24-36 точек) является высокая частота развития задержки мочеиспускания (10%).
Локализация участков забора ткани и количество столбиков.
При первичной биопсии забор ткани следует выполнять в периферических отделах предстательной железы как можно более латерально и сзади.
Дополнительные столбики нужно взять при помощи пальцевого ректального исследования/ТРУЗИ из предполагаемых пораженных участков, которые определяются индивидуально в каждом случае.
Секстантная биопсия больше не считается эффективной. При объеме предстательной железы 30–40 см. куб. необходимо взять не менее 8 столбиков. С увеличением количества столбиков более 12 точность анализа существенно не изменяется. По результатам Британского исследования по диагностике и лечению рака предстательной железы была рекомендована 10-точечная биопсия.
Диагностическая ТУР предстательной железы.
Проведение диагностической ТУР предстательной железы вместо повторных биопсий нецелесообразно. Частота обнаружения раковых клеток при этом методе не превышает 8%, что свидетельствует о его неэффективности при диагностике рака.
Биопсия семенных пузырьков.
Четкие показания для проведения биопсии семенных пузырьков пока не определены. При уровне ПСА > 15–20 нг/мл биопсия показана, только если ее результаты будут иметь решающее значение при определинии тактики лечения. При уровне ПСА > 15–20 нг/мл вероятность прорастания опухоли в семенные пузырьки составляет 20–25%.
Биопсия переходной зоны.
Первичная биопсия с забором ткани переходной зоны характеризуется очень низкой частотой обнаружения рака предстательной железы, поэтому забор ткани из переходной зоны простаты следует проводить только при повторной биопсии.
Целесообразность назначения антибиотиков при биопсии простаты.
Применение пероральных или внутривенных форм антибиотиков является самым современным методом профилактики осложнений. Оптимальная дозировка и продолжительность курса определяются индивидуально.
Предпочтительными препаратами считаются фторхинолоны, при этом ципрофлоксацин более эффективен, чем офлоксацин. Антибиотики назначаются за день до биопсии предстательной железы, и принимаются в течение 7-10 дней.
Местная анестезия при биопсии простаты.
Современным методом местной анестезии при биопсии предстательной железы является перипростатическая нервная блокада под контролем ультразвука. Расположение депо анестетика (в верхушке или основании) не имеет значения.
Интраректальное введение местного анестетика значительно уступает по эффективности перипростатическому его введению.
Тонкоигольная аспирационная биопсия простаты.
Тонкоигольная аспирационная биопсия предстательной железы менее эффективна, чем трансректальная биопсия простаты специальной биопсийной иглой под контролем ТРУЗИ.
При помощи трансректальной биопсии можно точно определить сумму баллов по Глисону и распространенность опухоли в пределах простаты.
Осложнения биопсии простаты.
Частота развития осложений после биопсии предстательной железы невысока. Среди незначительных осложнений встречаются такие, как макрогематурия (14,5%) и гематоспермия (37,4%). Серьезные инфекционные осложнения после биопсии наблюдались менее чем в 1% случаев. Частота острой задержки мочи не превышает 0,2%.
Увеличение в последнее время количества столбиков при проведении биопсии не привело к росту частоты серьезных осложнений, требующих лечения. Прием аспирина в малых дозах больше не считается абсолютным противопоказанием к проведению биопсии простаты.
Патоморфологическое исследование пункционных биоптатов предстательной железы.
Макроскопическое исследование и подготовка материала.
Материалы биопсии предстательной железы, полученные с разных участков, обычно направляются в патоморфологическую лабораторию в отдельных пробирках и должны подвергаться обработке в отдельных контейнерах. Перед обработкой регистрируют количество столбиков в каждой пробирке и длину каждого столбика.
Установлено, что длина биоптата предстательной железы в патоморфологическом препарате существенно влияет на частоту обнаружения рака предстательной железы. Чтобы отдельные столбики были плоскими и ровными, в один контейнер помещают не более 3 столбиков и используют губку и бумагу.
Для лучшего обнаружения небольших очагов опухоли блоки следует разрезать на 3 части. Рекомендуется также фиксировать промежуточные срезы на случай, если потребуется дополнительное иммуногистохимическое исследование.
Микроскопическое исследование и заключение.
Диагностика рака предстательной железы основывается на патоморфологическом исследовании. Тем не менее, иммуногистохимия также может быть эффективной. При подозрении на опухоль в биоптате, сомнения насчет диагноза,зачастую, можно разрешить с помощью консультации коллег или получения мнения специалистов сторонней организации.
В заключении по биопсии предстательной железы следует использовать четкую, ясную терминологию и избегать таких терминов, как «атипия», «атипичные железы» и «потенциально злокачественное новообразование».
Для каждого участка биопсии следует указывать процент положительных столбиков с карциномой и сумму баллов по Глисону на основании системы, принятой в 2005 г. Согласно действующему международному соглашению (модифицированная) сумма баллов по Глисону для опухолей, выявленных при биопсии предстательной железы, состоит из балла по шкале Глисона, доминантного (наиболее обширного) компонента карциномы, и наивысшего балла независимо от обширности компонента (правило 5% не применяется).
Если карцинома преимущественно состоит из компонентов с баллом 4/5, небольшой процент обнаруженных клеток (
Целью патоморфологического исследования материала радикальной простатэктомии является предоставление информации о патоморфологической стадии рака предстательной железы, степени дифференцировки и состоянии хирургического края.
В заключении должны быть отражены следующие параметры:
- Типирование (> 95% рака предстательной железы представляют типичные (ацинарные) аденокарциномы);
- Сумма баллов по Глисону;
- Стадирование и состояние хирургического края опухоли;
- При необходимости локализация и размер распространения за пределы предстательной железы, наличие инвазии в шейку мочевого пузыря, инвазия семенных пузырьков, локализация и размер участка положительного хирургического края;
- Можно дополнительно указать информацию о множественности, диаметре доминирующей опухоли и зональное расположение (переходная, периферическая зона, передняя поверхность) доминирующей опухоли;
- Количество удаленных лимфоузлов с каждой стороны и количество пораженных лимфоузлов.
Сумма баллов по Глисону.
Оценка аденокарциномы предстательной железы по шкале Глисона является самым надежным прогностическим фактором клинического поведения опухоли и результатов лечения. Поэтому сумму баллов по Глисону включают как один из параметров в номограммы, оценивающие риск рецидива после простатэктомии.
Сумма баллов по Глисону – это сумма баллов 2 самых доминантных (по объему) участков по шкале Глисона. Если присутствует только 1 балл, он удваивается. Если участок занимает менее 5% объема опухоли, его балл не учитывается в сумме баллов по Глисону (правило 5%).
Кроме суммы баллов по Глисону, необходимо указывать отдельно первичный и вторичный баллы (например, сумма баллов по Глисону 7 [4 + 3]). При множественных опухолях дается общая сумма баллов по Глисону с обязательным указанием самой высокой оценки отдельного очага опухоли. Третичный балл по шкале Глисона 4 или 5, особенно если его участок превышает 5% объема опухоли предстательной железы, является неблагоприятным прогностическим фактором биохимического рецидива.
В дополнение к сумме баллов по Глисону, следует указывать наличие третичного балла и примерный процент соответствующего участка от объема опухоли.
Определение экстрапростатического распространения опухоли.
Для обозначения наличия опухоли за пределами предстательной железы рекомендуется употреблять термин «экстрапростатическое распространение».
Экстрапростатическое распространение определяют как аденокарциному, проросшую в перипростатическую клетчатку или распространившуюся за пределы предстательной железы, например в сосудисто-нервный пучок.
Инвазия в шейку мочевого пузыря также рассматривается как экстрапростатическое распространение. Рекомендуется указывать не только расположение, но и степень экстрапростатического распространения, поскольку она влияет на риск рецидива.
Не существует общепринятого международного определения терминов «очаговое», «неочаговое» и «обширное экстрапростатическое распространение». Одни исследователи к очаговому относят экстрапростатическое распространение «в нескольких железистых элементах» или распространение менее 1 поля зрения при большом увеличении микроскопа, тогда как другие измеряют глубину распротранения в мм.
В настоящее время клинически целесообразным представляется определять размер экстрапростатического распространения (например, «менее или бо-лее 1 поля зрения при большом увеличении микроскопа» или «1 мм»).
Относительно верхушки предстательной железы не существует единого мнения о способе определения экстрапростатического распространения в этой локализации. В данном случае прорастание опухоли в скелетные мышцы не рассматривается как экстрапростатическое распространение. Следует отметить, что для опухоли в верхушке предстательной железы не существует стадии pT4.
В шейке мочево гопузыря следует различать микроскопическую инвазию тонких волокон гладкой мышцы и обширную инвазию стенки мочевого пузыря, поскольку первая не является независимым прогностическим фактором биохимического рецидива и должна рассматриваться как экстрапростатическое распространение (pT3a).
Положительный хирургический край шейки мочевого пузыря должен обозначаться как экстрапростатическое распространение (pT3a) с положительным хирургическим краем, а не как стадия pT4.
Некоторые исследователи рассматривают инвазию толстых волокон гладких мышц как обширную инвазию, которая определяется урологом.
Объем опухоли при раке предстательной железы.
Мнения о прогностической ценности объема опухоли предстательной железы в материале после радикальной простатэктомии неоднозначны, учитывая несколько противоречивых исследований, которые подтверждают либо опровергают этот показатель как независимый прогностический фактор.
Тем не менее, граничный объем рака предстательной железы 0,5 см. куб. продолжают использовать как важный критерий дифференциации клинически значимых и не значимых опухолей.
Кроме того, усовершенствование рентгенографических методов позволяет более точно определить объем опухоли без хирургического вмешательства.
Таким образом, при наличии доминирующего опухолевого узла рекомендуется указывать его максимальный диаметр в миллиметрах.
Состояние хирургического края.
Состояние хирургического края является независимым фактором риска биохимического рецидива.
Как правило, можно получить точную информацию о состоянии хирургического края:
• Край является положительным, если опухолевые клетки контактируют с окрашенным краем образца;
• Край является отрицательным, если опухолевые клетки располагаются очень близко к окрашенному краю или на неокрашенной поверхности ткани.
Если на ткани имеются серьезные повреждения (как правило, в верхушке), определить состояние хирургического края не всегда возможно.
Состояние хирургического края не зависит от стадии рака, а положительный край не свидетельствует об экстрапростатическом распространении. Для подтверждения связи между размером положительного края и риском рецидива недостаточно научно обоснованных доказательств.
Однако, необходимо указывать (много) очаговость и размер положительного края, например линейный размер в миллиметрах или количество блоков с положительным краем.
Источник www.docmilenin.com


Трузы при раке простаты — это очень важная тема! Я считаю, что выбор правильного нижнего белья может существенно помочь в комфортной жизни. Мягкие и свободные трусы уменьшают дискомфорт и помогают чувствовать себя увереннее. Берите это во внимание, друзья! Здоровье — это важно!