Болезнь не щадит никого, рак является одной из самых тяжелых. Если вовремя не обратиться к врачу, то могут возникнуть большие проблемы. Тогда только медикаментами тут уже не обойтись. Придется прибегнуть к кардинальным действиям, к которым относится лучевая терапия. При раке предстательной железы последствия ее непредсказуемые. Об этом мы сейчас и поговорим, но сначала…

Что такое лучевая терапия
Это эффективное и целесообразное лечение при онкологических патологиях, к которым относится и рак простаты. Основана она на ионизирующей радиации, действует целенаправленно, уничтожает только больные клетки, здоровые не подвергаются ее воздействию.
- Излучение ионов направляется туда, где находятся молекулы, содержащие воду и клетки опухоли.
- После попадания луча в них появляются пероксид водорода и свободные радикалы.
- Полученные продукты блокируют работу больных клеток, их рост и размножение.
Лечение рака предстательной железы лучевой терапией основывается еще и на том, что активность радикалов и пероксида водорода зависит от обмена веществ. Чем он выше, тем опухоль питается активнее, что, в свою очередь, ведет к увеличению пагубного воздействия на нее радиации.
Данный способ лечения применяется на всех стадиях развития болезни, независимо от области поражения органа и распространения метастазов. Кроме этого, эффективно используется лучевая терапия после удаления рака предстательной железы как профилактическое и лечебное средство.

Излучение, направленное на раковые клетки, делится на два типа:
- волновое – основано на гамма-излучении и рентгеновских лучах;
- корпускулярный метод – это протонная терапия, включающая в себя: электронное излучение, альфа- и бета-частицы, нейтронное и протонное излучение.
Существует три способа воздействия лучевой терапии на злокачественную опухоль:
- дистанционный;
- контактный;
- интерстициальный.
Разновидности процедуры
В настоящее время несколько разновидностей имеет лучевая терапия при раке предстательной железы, последствия и эффективность лечения зависят от формы заболевания:
- Конформная. Применяется в том случае, если возникает необходимость полного и равномерного облучения болезнетворной опухоли. Создается 3D-изображение образования. При этом учитываются все ткани и органы, находящиеся рядом. Ионы радиации влияют лишь на раковые клетки, неповрежденные органы и ткани остаются нетронутыми.
- С модулированной интенсивностью. Луч, который направляется на опухоль, разделяется на несколько более мелких. Сила каждого из лучевых потоков программируется. В связи с этим здоровые участки простаты получают малую дозу радиации, в то время как на болезнетворные клетки оказывается основное воздействие.
- Протонная. Специалисты считают, что этот способ самый эффективный при раке предстательной железы. Протоны воздействуют только на больные клетки, но не при всех формах рака данную процедуру назначают.
- Нейтронная. Используется в том случае, если другие методы не помогли.
Дистанционное облучение
Особенности данного вида облучения заключаются в том, что во время сеанса оказывается губительное воздействие не только на больные клетки, но и на здоровые. Для процедуры используется специальный аппарат, он помогает регулировать длину волн, что способствует максимально возможному снижению действия лучей на здоровую область.
Это оборудование высокоточное, и работать с ним может только специалист, прошедший подготовку. Если аппарат используется неправильно, пациент может не улучшить свое состояние, а, наоборот, ухудшить его.
Сначала проводится обследование, после чего строится объемное расположение опухоли, а затем врач старается направить радиоволны на нее.
Дистанционная лучевая терапия рака предстательной железы проводится каждый день или согласно графика, составленного лечащим врачом на протяжении семи-восьми недель.
Дистанционная терапия, в свою очередь, делится на два вида: неподвижный и мобильный.
Первый вид заключается в следующем:
- Больного располагают в одной конкретной позиции.
- Направляют на него источник излучения (он тоже стационарен).
Второй вид, мобильный:
- Передвигают источник излучения.
- Направляют его на опухоль простаты, аппарат передвигается вокруг пациента и действует на раковые клетки со всех сторон.
Иногда при использовании такого способа требуется небольшой перерыв в лечении.
Интерстициальный метод (брахитерапия)
Эффективное средство лечения рака — это брахитерапия. Наибольший успех данный метод имеет, если опухоль находится в пределах предстательной железы. Суть его заключается в следующем: при помощи специальной иглы внутрь опухоли вводится радиоактивное вещество. В качестве вещества используется йод -125 . Процедура проходит под контролем УЗИ.
В зависимости от того, как расположены капсулы, содержащие радиоактивное вещество, брахитерапия делится на:
- внутриполостную;
- внутритканевую;
- внутрисосудистую.

После процедуры пациент находится в стационаре сутки. Облегчение наступает через несколько дней. Радиоактивное вещество распадается в организме на протяжении двух месяцев. За это время раковые клетки погибают.
Главный плюс брахитерапии – радиация оказывает воздействие только на поврежденные клетки, здоровые остаются нетронутыми. Вот поэтому после данной процедуры развивается меньше осложнений, чем после дистанционного облучения.
Протонный метод и адъювантная терапия
Это один из неинвазивных видов лучевой терапии, помогающий избавиться от рака предстательной железы. Основывается этот способ на точнейшем действии радиации на патогенную точку, образовавшуюся в железе. Благодаря тому что доза распределяется точно, все формы раковых заболеваний полностью излечиваются. Побочных осложнений нет.
Следующий способ – это адъювантная лучевая терапия при раке предстательной железы. Используется как:
- профилактика;
- вспомогательное средство;
- средство, дополняющее хирургическое вмешательство.
Цель этой терапии – разрушение вторичной опухоли.
Этот способ оказывает влияние на распространение раковых клеток и их рост. Энергия мощного излучения способна убить больные клетки, которые остались после операции. Таким способом повышается эффективность лечения. В зависимости от желаемой цели, используется внутреннее или внешнее излучение. Оно направляется на место образования опухоли, снижается риск повторения онкологии в этой области.
Паллиативная лучевая терапия
Чаще всего используется такая лучевая терапия при раке предстательной железы. Последствия болезни в этом случае достигают четвертой стадии. Паллиативный вид направлен на облегчение состояния пациента. Наружная лучевая терапия способствует уменьшению опухоли и боли и предполагает проведение следующих мероприятий:
- Чтобы снять симптомы недуга, проводится хирургическое вмешательство, трансуретральная резекция простаты. Благодаря паллиативному лечению удается уменьшить развитие болезни.
- Назначается такой вид лучевой терапии в комплексе с гормональными препаратами на последней стадии рака предстательной железы. Это мероприятие снижает болевой синдром, устраняет побочные влияния раковых клеток.
- При обнаружении местнораспространенного рака простаты используется методика ультразвуковой абляции, которая тоже относится к паллиативной терапии. Она помогает устранить побочные эффекты болезни.
Последствия лучевой терапии
Хотя внедрение новых методик способно снизить негативные ощущения после процедуры, но все-таки это лучевая терапия. При раке предстательной железы последствия после нее все же существуют:
- Возникают проблемы с прямой кишкой. Может появиться диарея и синдром раздраженной кишки. Со временем эти неприятности уходят.
- Появляются вопросы, связанные с работой мочевого пузыря и мочеиспусканием. Больной страдает от частого мочеиспускания, жжения во время него и наличия крови в моче. Эти неприятности через некоторое время проходят.
- Развитие импотенции и нарушение эрекции. Частота возникновения этих проблем такая же, как и после хирургического вмешательства. Но существует различие: после операции импотенция развивается сразу же, а после облучения — постепенно, в течение года.
- После того как использовалась лучевая терапия при раке предстательной железы (отзывы пациентов, прошедших через эту процедуру, подтверждают это), в первое время чувствуется постоянная усталость и утомляемость. Это состояние сохраняется пару месяцев.
- Нарушается отток лимфы. Это является причиной отека нижних конечностей.
- Сужение уретры. Иногда повреждается мочеиспускательный канал, нарушается отток мочи.
Как вести себя во время лечения
Многих волнует вопрос: чего ожидать, после того как была проведена лучевая терапия при раке предстательной железы? Эффективность ее зависит от соблюдения следующих правил:
- В период проведения процедуры питание должно быть не только высококалорийным, но и полноценным. Рацион должен включать в себя все витамины и микроэлементы. Обязательно соблюдайте питьевой режим (до трех литров жидкости в сутки).
- Откажитесь от курения и употребления спиртных напитков.
- Одежда должна быть свободной, легкой, из натуральных тканей. Желательно зоны облучения держать открытыми. При выходе на улицу их необходимо защищать от солнца.
- Не пользуйтесь мылом и другой косметикой. Во время принятия душа помните о метках на теле.
- При появлении покраснения, зуда, сильного потоотделения обязательно обратитесь к лечащему врачу.
- Постоянные прогулки на свежем воздухе, соответствующая физическая активность, крепкий и полноценный сон – это еще один шаг к избавлению от недуга.
Жизнь после лучевой терапии
Восстановление начинается сразу же после окончания сеансов облучения. Оно включает в себя такие моменты:
- отдых в течение дня;
- полноценный сон;
- щадящий режим;
- эмоциональный настрой;
- правильное и полноценное питание;
- отказ от всех вредных привычек.
В этот период очень важна помощь не только врача, но и родных людей.
Так как лечение еще не закончено, придется ходить на процедуры и исследования, эмоциональное состояние в связи с этим часто меняется. Главное в этот период — не замыкаться в себе, общаться с друзьями и родственниками. Постарайтесь соблюдать привычный ритм жизни, не отказывайтесь от домашних дел. Если немного устали, лягте, отдохните.
Если вы работаете, попросите руководство хотя бы на некоторое время перевести вас на легкий труд. Лучше всего, конечно, на период реабилитации взять отпуск.
Если будут соблюдаться все рекомендации врача, то реабилитационный период пройдет спокойно, быстро и легко.

Эффективность процедуры
На разных стадиях результаты разные:
- Облучение на первой стадии может заменить хирургическое вмешательство, остаются нетронутыми здоровые органы и ткани.
- После простатэктомии используется лучевая терапия при раке предстательной железы. Последствия после операции в этом случае становятся минимальными, так как уничтожаются патогенные клетки.
- На поздних стадиях болезни облучение уменьшает болевой синдром.
Ваше здоровье — в ваших руках. Старайтесь постоянно посещать врача. Он будет наблюдать за течением болезни и при малейшем ухудшении назначит лечение.
Источник fb.ru
Олег Борисович Карякин
Д.м.н. проф. зав. отделением лучевого и хирургического лечения урологических заболеваний МРНЦ РАМН (Обнинск)
Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.
Целесообразность применения гормоно-лучевой терапии доказана крупными международными исследованиями.
Рак предстательной железы (РПЖ) — одно из наиболее часто встречающихся злокачественных новообразований у мужчин среднего и пожилого возраста. По экспертным оценкам, в России в 2008 г. 9,7% заболеваемости злокачественными новообразованиями у мужского населения пришлось на долю РПЖ.
На сегодняшний день применяются оперативное, медикаментозное и лучевое лечение РПЖ. Между тем данные последних лет, полученные по результатам крупных международных клинических исследований, свидетельствуют опреимуществах комбинированного гормонолучевого лечения у больных РПЖ с неблагоприятным прогнозом. Подробнее об этом методе лечения мы решили узнать у Олега Борисовича Карякина, проф. д.м.н. зав. отделением лучевого и хирургического лечения урологических заболеваний Медицинского радиологического научного центра РАМН.
– Олег Борисович, эффективность лучевой терапии (ЛТ) как метода лечения РПЖ у специалистов не вызывает сомнений. Но как часто бывают случаи, когда только одного местного лечения недостаточно для получения длительной ремиссии? Чем обусловлена целесообразность применения гормональных препаратов в этом случае?
– Начну с того, что РПЖ относится к опухолям, которые чувствительны к ЛТ. Если при других локализациях, например при раке мочевого пузыря, этот метод может быть паллиативным, то в данном случае он достаточно эффективен и сравним с хирургией для больных с I, II идаже III стадией. Как известно, основные критерии в онкологии – это 5-летняя выживаемость и качество жизни пациента. Так вот, если говорить о 5-летней выживаемости, то по эффективности дистанционная ЛТ сравнима с хирургическим вмешательством, но после 5 лет наблюдения преимущество на стороне хирургии. Разница между ними заключается в том, что при ЛТ облучаются и предстательная железа, и лимфатические узлы (ЛУ), и окружающие органы, тогда как при хирургическом вмешательстве полностью удаляются предстательная железа, семенные пузырьки и окружающая клетчатка. Объем удаления ЛУ, в которых могут быть метастазы, определяется хирургом до или во время операции, что также влияет накачество жизни и результаты лечения. Помимо этого проводится гистологическое исследование удаленной ткани, в процессе которого выявляются «находки», которые невозможно обнаружить до операции или проведения ЛТ: проникновение опухоли за капсулу органа (видно только под микроскопом), прорастание в семенные пузырьки, микрометастазы. Методы лучевой диагностики, такие как магнитно-резонансная томография, компьютерная томография, ультразвуковое исследование, сделать это не позволяют. А это крайне важно для последующего лечения, подбора соответствующей тактики.
В последнее время онкоурологи стали широко использовать метод гормоно-лучевой терапии (ГЛТ), и для этого есть все основания. Статистика такова: оперативному вмешательству ввиду поздней диагностики в нашей стране могут подвергаться порядка 20–25% пациентов, находящихся в I, II, или начале III стадии онкозаболевания. У остальных пациентов (40–60%) опухоль уже вышла за пределы органа или имеются отсевы – макроили микрометастазы. Таким больным показана только ЛТ в сочетании с гормональной терапией (ГТ).
ЛТ – локальный метод, при котором определяется мишень для облучения: только ли предстательная железа, либо это будет расширенное поле с захватом всех ЛУ таза. Эту и другие задачи клиницист ставит радиологу для получения максимального терапевтического эффекта. Комбинация ЛТ и ГТ, как правило, показана для пациентов с местно-распространенным раком. У больных II, III, IV стадии РПЖ количество метастазов, которые мы, клиницисты, не видим, может соответственно возрастать, а такая комбинация создает некую пространственную кооперацию. С помощью ЛТ осуществляется местное лечение, а гормоны, в свою очередь, действуют на весь организм, на отсев всех злокачественных клеток, где бы они ни находились. Таким образом, обеспечивается общее и местное воздействие. В этом и состоит усиливающий эффект ГЛТ.
– Какова доказательная база применения ГЛТ? Какие исследования ГЛТ были, на Ваш взгляд, наиболее убедительными?
– Целесообразность применения ГЛТ объяснена и доказана рядом крупных международных клинических исследований. По сути, все основные исследования адъювантного применения аналогов лютеинизирующего гормона – рилизинг-гормона (ЛГРГ) после ЛТ проводились Европейской организацией по лечению иисследованию рака (EORTC) и Радиологической онкологической группой (RTOG) в 90-х годах прошлого века с использованием гозерелина. Достаточно убедительным по своему масштабу является исследование RTOG, которое включало 977 больных РПЖ в III и IV стадии. Пациентам назначали ГТ и ЛТ. В качестве ГТ использовался Золадекс (МН гозерелин). ЛТ назначалась в дозе 60–65 Гр. Исследование доказало преимущество комбинированной ГЛТ посравнению с ЛТ.
Эффективность ГЛТ также была подтверждена протоколами исследования RTOG 9202, в котором участвовало около 1500 больных. Статистически достоверные преимущества были выявлены в группе пациентов, получавших дистанционную ЛТ с длительной ГТ до, во время и на протяжении последующих 2 лет после окончания ЛТ. Отмечено улучшение показателей местного контроля над заболеванием, частоты прогрессирования и увеличения безрецидивной выживаемости по сравнению с больными, которым проводили дистанционную ЛТ и ГТ.
Применение антиандрогенов после ЛТ хорошо обосновано и в самом крупном мультицентровом плацебо-контролируемом исследовании раннего РПЖ по программе ЕРС, в котором пациенты после облучения получали бикалутамид как добавление к хирургическому вмешательству или после ЛТ. В одной группе пациентам оказывали исключительно хирургическую помощь, в другой добавляли препарат Касодекс (бикалутамид) в дозе 150 мг. В ходе исследования было доказано, что применение Касодекса после хирургического лечения илипосле ЛТ приводит к лучшим результатам иговорит в пользу комбинированного лечения для больных ранним РПЖ, которым было проведено радикальное лечение.
– А что Вы можете сказать о риске рецидивов при разных методах лечения РПЖ? Снижался ли он при их сочетании с ГТ?
– Конечно, любой метод терапии в онкологии не исключает рецидива болезни. Этот риск есть и будет, потому что все ныне существующие методы лечения рака неспецифичны по отношению к причине возникновения злокачественного образования. Основные 3 метода лечения: хирургический, ЛТ и химиотерапия (или ГТ) не направлены на причину появления рака, на те молекулярные изменения, которые возникают в клетках опухоли вследствие генетических нарушений либо воздействия внешних факторов. Поэтому рецидив вполне возможен. Другая причина его возникновения связана с сегодняшним уровнем диагностики, который, к сожалению, не позволяет с достаточной точностью выявить изменения, происходящие в организме человека и определить стадию заболевания. В результате процент ошибок по местному распространению РПЖ достигает 30%. Возможны неточности и при патологии в ЛУ. Неверно определенная стадия, в свою очередь, приводит к неправильно построенной тактике лечения и возможности рецидива. Не исключена его возможность и при использовании ГЛТ. Если говорить о биохимическом рецидиве, то следует напомнить, что контролем эффективности лечения РПЖ помимо обычных рентгенологических методов исследования крови, является исследование маркера ПСА простатспецифического антигена (гликопротеина), который обнаруживается в экскреторных протоках простаты. Все мужчины в возрасте 40–50 лет должны не только знать об этом маркере, но и регулярно сдавать анализ для определения его уровня в крови. Превышение нормы, составляющей 4 нг/мл, должно вызвать подозрение на появление злокачественного новообразования в предстательной железе, потребовать консультации уролога и проведения дифференциальной диагнстики.
Если после проведения ГЛТ уровень ПСА снижается, например с 30–35 до 1 нг/мл, то это считается очень хорошим результатом, и вероятность рецидива и дальнейшего развития болезни у такого пациента невелика. Если же снижение не столь существенное – до 10 нг/мл, то это говорит о том, что с помощью ГЛТ не удалось добиться необходимого клинического эффекта и можно ожидать прогрессирования болезни.
Исходя из протокола RTOG 8610, 10-летняя выживаемость больных РПЖ была достигнута в том случае, когда ГТ сочетали с ЛТ. При проведении комбинированной терапии безрецидивная выживаемость также была выше. В протоколе EORTC 22863, включавшем 415 больных, также использовалась дистанционно-лучевая терапия, а из гормональных препаратов Золадекс, 1 раз в 4 нед с первого дня начала дистанционно-лучевой терапии и в последующем напротяжении 3 лет. За период наблюдения, равный 9,1 года, показатели общей выживаемости составили 58% при комбинированном лечении и 39% – при только ЛТ. Эти различия достоверны.
– Олег Борисович, в вашем отделении проводится анализ результатов ГЛТ. Вы готовы ими поделиться?
– Да, наша клиника участвует в многоцентровых исследованиях с 1994 г. в первую очередь в протоколах EORTC. Ранее я был ответственным за эту работу по России и привлекал к ней другие клиники. Мы накопили достаточный опыт, а сейчас работаем и с другими компаниями и исследовательскими группами по тем протокольным исследованиям. Для нас важно принять участие в разработке новых технологий и потом, возможно, внедрить их в России и, конечно, приобрести новые знания.
В настоящее время в нашем отделении уже накоплен значительный опыт по проведению ГЛТ. Сейчас готовится диссертация одного из аспирантов. Думаю, что в ближайшие несколько месяцев мы сможем опубликовать эти материалы в широкой печати.
Но уже эти предварительные данные показывают достаточно высокую эффективность сочетания ГТ и ЛТ у больных с локализованным и местно-распространенным раком.
– Какие основные проблемы, по Вашему мнению, стоят сейчас перед онкоурологами-радиологами? Что, на Ваш взгляд, необходимо предпринять для улучшения качества оказания медицинской помощи пациентам, получающим лечение в радиологических центрах?
– В настоящее время онкологические больные лечатся как в крупных онкологических центрах, так и в областных онкодиспансерах. которые, к сожалению, не всегда оснащены хорошей радиотерапевтической аппаратурой. Да и радиологические центры по оснащенности также заметно отстают от европейских центров. Поэтому во многих российских онкоцентрах не применяют современную ГЛТ, а назначают лишь ГТ, что совершенно не оправдано инегативно влияет на результаты лечения.
Наряду с оснащенностью радиологических центров и онкодиспансеров необходимым оборудованием не менее остро стоит вопрос о подготовке высококвалифицированных кадров, поскольку радиологическое лечение весьма опасно при его неправильном применении: при ошибке планирования либо ошибки в дозиметрии могут возникнуть достаточно серьезные осложнения. Замечу, что у нас есть отделение лучевых повреждений, где лечатся пациенты, имеющие очень серьезные повреждения после ЛТ.
Что касается лекарственного обеспечения, то оно сегодня также является большой проблемой. Больной по окончании лечения в центре должен получать поддерживающую ГТ по месту жительства, но не всегда эти препараты есть в наличии и покрываются программой дополнительного лекарственного обеспечения. Больные, которые не могут их приобрести из-за отсутствия личных средств, оказываются недолеченными.
Конечно, проблемы есть как в онкоурологии, так и во всей российской медицине. Но наша задача – сделать их минимальными, чтобы организационные вопросы не отражались на здоровье пациентов.
Источник therapycancer.ru

Лучевая терапия — один из методов лечения рака предстательной железы с помощью направленного воздействия ионизирующего излучения на новообразование. Применение радиации наносит непоправимый ущерб раковым клеткам, препятствует их размножению и росту. Пострадавшие в ходе лечения здоровые клетки со временем восстанавливаются и начинают функционировать в прежнем режиме.
Обычно лучевая терапия используется совместно с гормональным лечением рака предстательной железы. Процедура эффективна при местно-распространенной опухоли, но может быть проведена в случае метастазирования раковых клеток в ближайшие части организма. Также радиотерапия используется после проведения хирургического вмешательства, когда новообразование имеет агрессивную форму или присутствуют признаки не до конца удаленных раковых клеток.
Специалисты выделяют два способа воздействия радиации на опухоль: контактный и дистанционный. В медицинской литературе контактный тип лечения называют брахитерапией.
Дистанционная лучевая терапия
Дистанционная лучевая терапия показана при лечении мужчин с локализованным (стадии Т1 или Т2) или местно-распространенным раком предстательной железы. В случае высокого риска рецидива заболевания онколог дополнительно назначает лекарственные средства, понижающие уровень тестостерона в крови. Одновременное лечение, по оценкам проведенных исследований, увеличивает выживаемость в среднем до 2-3 лет.
Перед проведением процедуры врач с помощью компьютерного программного обеспечения составляет индивидуальный план лечения и визуализирует тазовую область пациента, определяя место на которое будут нацелены лучи аппарата. В некоторых отделениях лучевой терапии во внутрь предстательной железы помещаются специальные имплантаты размером два миллиметра. Они помогают рентгенологу точнее направлять радиационный луч.
Проведение процедуры
После проведения всех подготовительных процедур пациент начинает посещение процедурного кабинета. Лучевая терапия проводится каждый будний день в течение 4-8 недель, среднее время сеанса составляет не более 20 минут. Такой промежуток времени позволяет минимизировать риск травмирования здоровой ткани вблизи опухоли. Большинство мужчин получают среднюю дозу облучения в 75,6 Гр (Грей).
Лечение является безболезненным. Перед его началом мужчина переодевается в больничный халат, проходит в радиологический кабинет и при помощи иммобилизационных приспособлений размещается на процедурном столе.
Радиолог устанавливает аппарат в соответствии с ранее полученными данными, проверяет точность укладки пациента, выходит и дистанционно включает устройство. Линейный ускоритель начинает перемещаться вокруг кушетки, при этом самого излучения не видно, возможно присутствие непонятного запаха вследствие образования озона.
Проведение процедуры облучения рака простаты:
Типы процедуры
Существует три распространенных типа дистанционной лучевой терапии:
- 3D-конформная (3D-CRT).
- Интенсивно-модулированная (IMRT).
- Под визуальным контролем.
3D-конформная лучевая терапия (3D-CRT): аппарат использует трехмерную систему сканирования, которая помогает определить местоположение простаты, ее размер и форму. На основе полученных данных определяется доза излучения и увеличивается точность направления луча. Технология помогает минимизировать повреждения здоровой ткани вокруг опухоли и уменьшить риск возникновения побочных эффектов.
Интенсивно-модулированная лучевая терапия (IMRT): данный тип оборудования использует более 100 датчиков сканирования для последующего построения трехмерной картины опухоли предстательной железы. Преимуществом IMRT является регулирование интенсивности каждого луча во время лечения, позволяющее повышать или понижать дозу облучения в определенных участках малого таза.
Лучевая терапия под визуальным контролем (IGRT): при помощи технологии визуализации радиолог получает координаты местонахождения опухоли до процедуры или в режиме реального времени и сопоставляет их с ранее смоделированным изображением на этапе подготовки. В случае смещения новообразования производится мгновенная коррекция излучения для достижения лучшего эффекта и защиты ближайших органов от повреждения.

Побочные эффекты
Побочные эффекты не проявляются до второй или третьей недели лечения, но могут продолжаться в течение длительного периода после прохождения терапии и перерасти в хронические заболевания. Применение аппаратов с высокой точностью излучения на участок опухоли снижает риск возникновения осложнений. Для купирования некоторых симптомов лечащий врач может назначить антидиарейные средства и лекарства для снижения частоты мочеиспускания.
Эректильная дисфункция является наиболее часто встречающейся проблемой применения лучевой терапии. Она возникает вследствие повреждения радиацией небольших кровеносных сосудов или нервов, контролирующих эрекцию. Также осложнение может возникнуть из-за частичного облучения луковицы полового члена, которая находится ниже предстательной железы.
Проблемы с импотенцией возникают не сразу, но со временем могут развиться и перейти в хроническую стадию. Исследования показывают, что у 63% мужчин, прошедших лучевую терапию, наблюдается эректильная дисфункция по прошествии пяти лет после проведения процедуры. В более половине случаев справиться с патологией поможет консультация уролога и прием лекарственных средств для поддержания потенции: Виагра, Сиалис и Левитра.
Начиная с середины лечения у мужчины может возникнуть жжение при мочеиспускании и внезапное желание помочиться . Раздражение подкладки мочевого пузыря и мочеиспускательного канала иногда вызывает кровотечение. Обычно побочные эффекты исчезают через 2-3 недели после окончания терапии. В некоторых случаях они остаются и проявляются в виде кратковременных симптомов, описанных выше.
Радиотерапия может вызвать повреждение тонких кровеносных сосудов в кишечнике и прямой кишке. В результате мужчина сталкивается с ректальными проблемами , которые проявляются в виде:
- диареи;
- частого опорожнения кишечника;
- болей в животе или заднем проходе;
- кровотечений из заднего прохода;
- недержания кала (в очень редких случаях).
Проблемы начинаются вскоре после начала лечения и продолжаются вплоть до его окончания. Некоторые мужчины могут ощущать кратковременные симптомы, описанные выше, через несколько месяцев или лет после окончания терапии.
К мене распространенным побочным эффектам относятся раздражение кожи, выпадение лобковых волос и постоянное чувство усталости. Обо всех осложнениях необходимо сообщать лечащему врачу, медсестре или рентгенологу.

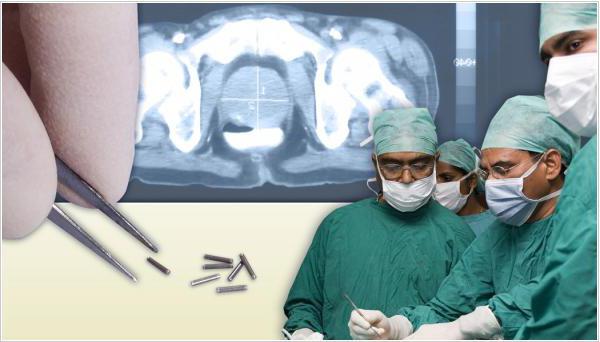
Брахитерапия
Брахитерапия — контактная форма лучевой терапии, применяемая на ранних стадиях рака предстательной железы. Принцип действия заключается в возможности подведения источника излучения непосредственно к пораженным клеткам опухоли при помощи подкожной инъекции. В результате новообразование получает максимальные дозы облучения. Риск повреждения здоровых тканей в прямой кишке и мочевом пузыре минимизируется.
В зависимости от состояния больного, врач назначает брахитерапию с высокой (HDR) или низкой (LDR) концентрацией облучения. Первый вариант предполагает использование радиоактивного материала в течение короткого промежутка времени. Низкодозная брахитерапия подразумевает введение в простату крошечных имплантатов с низкой дозой облучения, которые остаются там на три месяца.
Брахитерапия с высокой дозой облучения
HDR-брахитерапия назначается мужчинам с высоким уровнем ПСА и местно-распространенным типом рака простаты. Ее главным преимуществом является мощный короткий импульс радиационного излучения, в ходе которого погибают многие раковые клетки. Длительность сеанса составляет не более 20 минут.
Перед началом проведения процедуры онколог с помощью УЗИ, КТ или МРТ создает визуальную трехмерную копию простаты пациента, определяет дозировку и время облучения. Суть метода заключается в введении игл-троакаров через промежность к месту образования опухоли и подачи по ним источника излучения. Подготовка, введение и последующее извлечение игл может занимать 2-3 часа.
Во время сеанса мужчина находится под общим наркозом или эпидуральной анестезией. После удаления игл его будят, переводят в палату и оставляют на одну ночь в больнице под наблюдением медицинского персонала.
Лечение рака предстательной железы методом брахитерапии
Брахитерапия с низкой дозой облучения
LDR-брахитерапия подходит для мужчин с предстательной железой малого и среднего размера, небольшой опухолью и показателем уровня ПСА менее 10 нг/мл. Перед началом процедуры визуализируется тазовая область пациента для определения места введения радиоактивного материала и уровня излучения.
Низкодозная брахитерапия рака простаты проводится в течение 1-2 часов. Под общим наркозом пациенту через промежность при помощи визуального контроля имплантируют 50-70 изотопов в место нахождения опухоли. Использование специальных игл, которые создают небольшие отверстия для прокола, позволяет быстрее восстановиться после процедуры.
Выписка больного производится на следующей день. Мужчине запрещается в течение 2-3 месяцев сажать к себе на колени детей и домашних животных, кататься на велосипеде и избегать длительного пребывания на солнце.
Побочные эффекты
Имплантация радиоактивных материалов вызывает минимальный дискомфорт, но может привести к ряду побочных эффектов: боль при мочеиспускании, слабый напор мочи и раздражение мочевого пузыря. Они проявляются на 1-2 неделю после лечения и исчезают в течение полугода после его окончания. Прием медикаментозных средств купирует часть симптомов.
Импотенция и эректильная дисфункция обычно возникают после брахитерапии с высокой дозой облучения. Также могут возникнуть боли при эякуляции и оргазмы без семяизвержения. Следует поговорить с лечащим врачом на предмет управления побочными эффектами до и после терапии рака предстательной железы.

Последующее наблюдение
После окончания дистанционной лучевой терапии врач назначит дополнительные тесты, которые помогут оценить ответную реакцию опухоли на лечение.
Анализы на уровень ПСА начнутся через 2-3 месяца после завершения терапии. Тестирование обычно происходит каждые 3-4 месяца в течение первых 2-3 лет после проведения последней процедуры, а затем каждые шесть месяцев. Может потребоваться от 18 до 24 месяцев, чтобы показатели антигена опустились до минимальных значений.
После начала брахитерапии с низкой дозой облучения через 3-4 недели пациенту назначают проведение компьютерной томографии. Сканирование помогает оценить расположение имплантата и его влияние на раковые клетки. Дополнительно проводится консультация с урологом. Врач проводит осмотр больного и в случае обнаружения побочных эффектов или осложнений выписывает лекарственные препараты для их купирования.
Источник mypochka.ru