Рецидив после радикального лечения
Риск рецидива (местного или системного) в течение 10 лет после простатэктомии или лучевой терапии составляет 27—53%. В течение 5 лет после первоначального лечения от 16 до 35% больных получают противорецидивное лечение. Ранее под рецидивом понимали опухоль, пальпируемую через прямую кишку, а также отдалённые метастазы.
Сейчас рецидивом считают рост уровня простатоспецифичного антигена (ПСА). Критерием рецидива после простатэктомии обычно считают уровень ПСА 0,2 нг/мл и более при двух последовательных измерениях. О рецидиве после лучевой терапии, согласно критериям ASTRO, можно говорить при трёх последовательных повышениях уровня простатоспецифичного антигена.
Местные и системные рецидивы
Если обнаружено повышение уровня ПСА, важно установить характер рецидива — местный или системный. После простатэктомии может идти речь о местном рецидиве, в остальных случаях — только о системном рецидиве или их сочетании. Отличить местный рецидив от системного помогает время до повышения уровня ПСА, скорость прироста и время удвоения содержания ПСА, исходный уровень его и индекс Глисона (табл. 4-9).
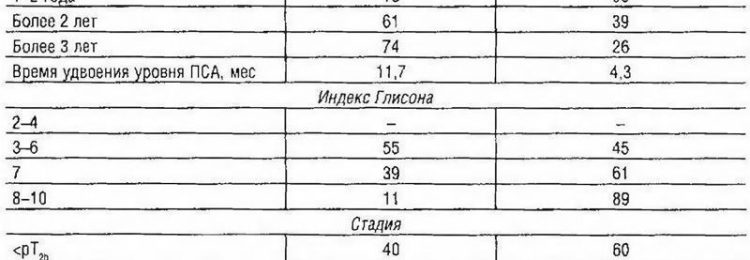
Таблица 4-9. Клинические и патогистологические характеристики местного и системного рецидива после радикальной простатэктомии

Увеличение уровня ПСА в первые полгода после операции обычно указывает на системный рецидив. Медиана времени удвоения уровня простатоспецифичного антигена при системных рецидивах может составлять 4,3, при местных — 11,7 мес. Скорость прироста уровня ПСА менее 0,75 нг/мл в год наблюдают у больных с местными рецидивами, более 0,7 нг/мл в год — у больных с отдалёнными метастазами.
На местный рецидив после лучевой терапии указывает медленный отсроченный рост уровня ПСА. Подтверждением местного рецидива служит положительный результат биопсии, выполненной через 18 мес после облучения и позже (при отсутствии отдалённых метастазов по данным компьютерной томографии (КТ), магнитно-резонансной томографии (МРТ) и сцинтиграфии).
Вероятность местного рецидива после простатэктомии составляет 80% при позднем подъёме уровня ПСА (более 3 лет), времени удвоения уровня ПСА более 11 мес, индексе Глисона менее 6 и стадии процесса ниже pT3aN0 и pTxR1. Вероятность системного рецидива после простатэктомии превышает 80% при раннем подъёме уровня простатоспецифичного антигена (менее одного года), времени удвоения уровня ПСА 4—6 мес, индексе Глисона 8—10, стадии рТ3b и pTxN1.
Местный рецидив после лучевой терапии и HIFU диагностируют при положительном результате биопсии при отсутствии отдалённых метастазов. Биопсия предстательной железы показана лишь отдельным больным при планировании повторного местного лечения (например, простатэктомии или повторного сеанса HIFU).
Обследование при подозрении на рецидив
Для подтверждения рецидива при повышении уровня ПСА обычно проводят физикальное обследование, УЗИ, КТ или МРТ малого таза, биопсию ложа опухоли и области анастомоза. При отсутствии симптомов эти исследования редко обнаруживают опухоль, так как рост уровня ПСА обычно происходит за 6—48 мес до явного рецидива.
Пальцевое ректальное исследование при нулевом или очень низком уровне ПСА обычно не приносит результатов. При повышении уровня простатоспецифичного антигена назначают МРТ малого таза, КТ брюшной полости и сцинтиграфию костей, но из-за низкой чувствительности и специфичности при раннем рецидиве эти исследования малоинформативны. При подъёме уровня ПСА после простатэктомии результат сцинтиграфии положителен лишь у 4,1% больных. Вероятность положительного результата сцинтиграфии не превышает 5%, пока уровень ПСА не достигнет 40 нг/мл.
Средний уровень ПСА, при котором сцинтиграфия обнаруживает метастазы, должен превышать 60 нг/мл, а скорость прироста уровня ПСА — 22 нг/мл в год. Уровень и скорость прироста содержания простатоспецифичного антигена позволяют предсказать результат сцинтиграфии, а скорость прироста уровня ПСА — результат КТ. Таким образом, при уровне ПСА менее 20 нг/мл или скорости прироста содержания ПСА менее 20 нг/мл в год сцинтиграфия и КТ не приносят дополнительной информации. Эндоректальная МРТ обнаруживает местный рецидив у 81% больных со средним уровнем ПСА 2 нг/мл. ПЭТ рекомендуют для ранней диагностики рецидивов различных опухолей.
Сцинтиграфия с антителами к простатическому мембранному антигену (простасцинт) — один из новых методов обнаружения рецидивов. Его диагностическая точность достигает 81%. Независимо от уровня простатоспецифичного антигена метод обнаруживает возникновение рецидива у 60—80% больных, что может помочь при выборе тактики лечения. Сцинтиграфия с этими антителами положительна у 72 из 255 больных с уровнем ПСА 0,1—4 нг/мл после простатэктомии, причём накопление изотопа наблюдают при любом уровне ПСА.
Биопсия зоны анастомоза позволяет обнаружить рецидив только у 54% больных. Лишь при наличии пальпируемого или гипоэхогенного образования вероятность положительного результата приближена к 80%. Существует чёткая зависимость между этим показателем и уровнем ПСА: при содержании ПСА менее 0,5 нг/мл результат положителен у 28% больных, при уровне простатоспецифичного антигена более 2 нг/мл — у 70% больных. Учитывая эти данные, биопсию из зоны анастомоза обычно не берут и ориентируются на уровень ПСА и скорость его удвоения. Кроме того, выживаемость при доказанных рецидивах примерно такая же, как при регистрации изолированного повышении ПСА.
Согласно рекомендациям ASTRO, при повышении уровня ПСА после лучевой терапии биопсия предстательной железы не показана. Впрочем биопсия имеет ключевое значение для решения вопроса о простатэктомии или HIFU у таких больных. После лучевой терапии (дистанционной или брахитерапии) биопсию обычно проводят не ранее чем через 18 мес после криодеструкции или через 6 мес после ультразвуковой деструкции.
Клинические рекомендации по обследованию при подозрении на рецидив
Лечение рецидивов после радикальной простатэктомии
Гормонотерапия
При высоком дооперационном уровне ПСА (более 20 нг/м, индексе Глисона более 7, нерадикальной операции и местнораспространённых опухолях pT3b, pTхN1) целесообразна ранняя гормонотерапия. Однако её влияние на выживаемость до сих пор не установлено. При ранней гормонотерапии метастазы возникают реже, чем при отсроченной, выживаемость в обоих случаях примерно одинаковая. Необходимость гормонотерапии подтверждает испытание MRC, в котором рецидив был отмечен у всех больных, получивших лучевую терапию по поводу роста уровня ПСА после простатэктомии при опухолях pT3b, pTxN1 и индексе Глисона 8.
Монотсрапию антиандрогенными препаратами больные переносят лучше, чем комбинированную (реже возникают приливы, снижение потенции, утрата полового влечения), однако антиандрогены вызывают гинекомастию и боль в сосках. У больных без отдалённых метастазов бикалутамид (по 150 мг/сут) достоверно снижает риск прогрессирования заболевания. Таким образом, антиандрогены могут быть альтернативой кастрации при повышении уровня простатоспецифичного антигена после радикального лечения (особенно у относительно молодых больных без сопутствующих заболеваний).
Наблюдение
Динамическое наблюдение обычно проводят при индексе Глисона менее 7, позднем (через 2 года после операции) повышении уровня ПСА и времени его удвоения более 10 месяцев. В таких случаях медиана времени до возникновения метастазов составляет 8 лет, а медиана времени от возникновения метастазов до наступления летального исхода — ещё 5 лет. HIFU-терапия
В последнее время появляется всё больше данных о результатах HIFU-терапии местного рецидива после РПЭ. Чаще всего рецидив обнаруживают при ТРУЗИ и подтверждают гистологически (биопсия). Тем не менее HIFU-терапия лишь отодвигает сроки назначения гормонотерапии. Точные данные о выживаемости отсутствуют.
Клинические рекомендации по лечению рецидива после простатэктомии
Лечение рецидива после лучевой терапии
Наиболее часто больные с рецидивом после лучевой терапии получают гормонотерапию (до 92%). Без лечения время от повышения уровня ПСА до манифестации рецидива составляет около 3 лет. Кроме гормонотерапии при рецидиве после облучения возможно и местное лечение — простатэктомия, HIFU-терапия, криотерапия, брахитерапия. Простатэктомия не нашла широкого применения из-за частых осложнений (недержание мочи, повреждение прямой кишки), а также из-за высокого риска местного рецидива. Однако при тщательном отборе больных эта операция может обеспечить длительный безрецидивный период.
По последним данным, 5-летняя безрецидивная выживаемость после лучевой терапии соответствует таковой после первичной простатэктомии, проведённой на тех же стадиях заболевания, 10-летняя выживаемость составляет 60—66%. В течение 10 лет от прогрессирования опухоли умирают 25—30% больных. При локализованных опухолях, отсутствии опухолевых клеток в крае резекции, инвазии семенных пузырьков и метастазирования в лимфатические узлы безрецидивная выживаемость достигает 70—80% по сравнению с 40—60% при местнораспространённых опухолях.
Простатэктомия при местном рецидиве оправдана при отсутствии тяжёлых сопутствующих заболеваний, ожидаемой продолжительности жизни не менее 10 лет, опухолях Т1-2, индексе Глисона менее 7 и уровне простатоспецифичного антигена менее 10 нг/мл. В остальных случаях до операции сложно определить распространённость опухоли, что повышает риск передней или тотальной экзентерации, осложнений, а также повторного рецидива.
Рекомендовано динамическое наблюдение за больными с вероятным местным рецидивом (из группы низкого риска, с поздним рецидивом и медленным ростом уровня ПСА), настроенными против повторного радикального лечения. Ретроспективный анализ не обнаружил преимуществ гормонотерапии по сравнению с динамическим наблюдением при времени удвоения уровня ПСА более 12 мес: 5-летняя выживаемость без метастазирования составила 88% при гормонотерапии и 92% — на фоне наблюдения.
Клинические рекомендации по лечению рецидива после лучевой терапии
Таблица 4-10. Клинические рекомендации по лечению рецидивов после радикального лечения

Качество жизни при лечении больных локализованным раком предстательной железы
В современной литературе большое внимание уделяют проблеме качества жизни у пациентов с раком предстательной железы после завершения лечения. Все современные методы лечения рака предстательной железы (РПЖ) влекут за собой серьезные и продолжительные осложнения, в то время как выделить наиболее эффективный метод среди прочих в настоящее время невозможно. Для большинства онкологических заболеваний 5-летняя выживаемость нередко служит показателем излечения, в то время как смертность от локализованного РПЖ в первые 5 лет, наоборот, явление нечастое.
Таким образом, значительная ожидаемая продолжительность жизни диктует необходимость учёта мнения пациента при выборе лечебной тактики, а последствия лечения не должны быть тяжелее самого заболевания. В связи с этим всё большее внимание в последние годы уделяют не только эффективности метода лечения, но и его влиянию на качество жизни пациента.
Качество жизни, связанное со здоровьем
Понятие «качество жизни» тесно связано с определением здоровья, принятым Всемирной организацией здравоохранения. В его рамках рассматривают не только физические, но и психические и социальные аспекты жизнедеятельности человека. В более узких медицинских рамках используют понятие «качество жизни, связанное со здоровьем» (health-related quality of life), не рассматривающее культурные, социальные или политические факторы и позволяющее акцентировать внимание на влиянии заболевания и его лечения на качество жизни пациента.
Качество жизни зависит от личностных качеств пациента, внутреннего восприятия заболевания, психологического благополучия, степени выраженности симптомов заболевания и/или последствий его лечения. Все эти компоненты формируют персональное представление пациента о его болезни, порой отличное от видения врача. Практика показывает, что отсутствие инструментально регистрируемых отклонений не умаляет значимости субъективного восприятия пациента и далеко не всегда соответствует последнему.
Сравнительная характеристика влияния современных методов лечения локализованного рака предстательной железы на качество жизни
Сложность выбора способа лечения локализованного РПЖ объясняют недостатком рандомизированных сравнительных исследований трёх основных методов: радикальной простатэктомии (РПЭ), дистанционной лучевой терапии и брахитерапии. Помимо изучения эффективности каждого из методов, важна оценка их влияния на качество жизни пациентов, поскольку именно оно нередко служит ключевым фактором в выборе определённой лечебной стратегии.
Использование опросника SF-36 показало преимущества РПЭ перед дистанционной лучевой терапией и брахитерапией. В течение первого месяца наблюдают существенный спад показателя QoL, характеризующего более тяжёлый послеоперационный период, однако уже через 4 мес отмечают его повышение до исходного уровня. Необходимо отметить, что исходный показатель QoL у пациентов, которым выполнена радикальная простатэктомия, на 7—10 пунктов выше, чем в других группах. Это объясняют тем, что возраст пациентов, выбравших оперативное лечение, в среднем на 6 лет меньше.
Несмотря на невысокую частоту послеоперационных осложнений, наименее предпочтительным методом с точки зрения влияния на качество жизни считают брахитерапию (диаграмма 4-1). В сравнении с контрольной группой (пациенты без лечения) после брахитерапии наблюдали расстройства мочеиспускания (ирритативные симптомы и уменьшение объёмной скорости мочеиспускания), сексуальной функции, нарушения со стороны желудочно-кишечного тракта.

Диаграмма 4-1. Динамика показателя общего качества жизни после различных методов лечения локализованного рака предстательной железы
При применении дистанционной лучевой терапии на первый план выходят признаки лучевого поражения кишечника: диарея, кровотечения, обструкция. Часто происходит поражение прямой кишки: нередко наблюдают недержание кала вследствие лучевого поражения нервов, иннервирующих анальный сфинктер. Тот же механизм лежит в основе развития эректильной дисфункции.
У пациентов, которым выполнена радикальная простатэктомия, обнаруживают недержание мочи и сексуальные расстройства, однако в целом качество жизни считают самым высоким именно после оперативного лечения. Это можно объяснить тем, что операция — единственный гарантированный способ удаления локализованной опухоли, что даёт дополнительный психологический стимул для преодоления трудностей, связанных с послеоперационными осложнениями (диаграмма 4-2).

Диаграмма 4-2. Сравнительная характеристика влияния различных методов лечения рака предстательной железы на качество жизни пациентов
Расстройства мочеиспускания у пациентов после радикальной простатэктомии
Среди расстройств мочеиспускания после радикальной простатэктомии доминирует недержание мочи. Согласно исследованию Каракевич и соавт. (2000), именно это осложнение — основной фактор снижения качества жизни после радикальной простатэктомии. Его встречают в 15—60% случаев. Такой большой диапазон величин объясняют тем, что во многих случаях недержание мочи — временное явление, проходящее самостоятельно по прошествии нескольких недель или месяцев.
В отличие от нервосохраняющего варианта, применение традиционной методики РПЭ вдвое увеличивает продолжительность периода восстановления функции сфинктерного аппарата мочевого пузыря. Другой важный фактор, влияющий на частоту недержания мочи, — возраст пациента. Частота продолжительного недержания мочи (более двух лет) у больных в возрасте 60—69 лет составляет 5—10%, у пациентов старше 70 лет — 15%.
Только 61% пациентов через год после лечения способны удерживать мочу на дооперационном уровне, однако уже через 6 мес 90% пациентов не используют прокладок (диаграмма 4-3). Таким образом, несмотря на сохранение функциональных нарушений со стороны сфинктерного аппарата через 6 мес после операции, это не доставляет пациентам существенного беспокойства.

Диаграмма 4-3. Динамика отмечаемых пациентами симптомов нарушения мочеиспускания в течение 2 лет после радикальной простатэктомии
В случае сохранения недержания мочи в течение продолжительного периода возможно выполнение инъекций коллагена или имплантация искусственного сфинктера, однако к подобным мерам прибегают лишь 3% пациентов. Важно отметить, что наиболее продолжительное недержание мочи наблюдают у пациентов, отмечавших подобную симптоматику до операции.
Сексуальные расстройства после радикальной простатэктомии
Импотенция (эректильная дисфункция) — частое осложнение РПЭ, существенно влияющее на качество жизни пациентов. Это подтверждает тот факт, что многие мужчины при выборе метода лечения РПЖ ориентированы не на ббльшую ожидаемую продолжительность жизни, а на сохранение потенции. Подавляющее большинство пациентов сталкиваются с этой проблемой в первые месяцы после операции. Последующее восстановление нормальной половой функции вариабельно и зависит от наличия сексуальных расстройств до операции, гормонального статуса, применения нервосберегающей методики радикальной простатэктомии.
Однако даже при сохранении сосудисто-нервных пучков восстановление эректильной функции может занять месяцы и даже годы. Считают оправданным усиление эрекции с помощью применения медикаментозных средств: таблетированных ингибиторов фосфодиэстеразы-5, уретральных суппозиториев, интракавернозных инъекций препаратов простагландина, а также использования вакуумных устройств. Высокоэффективным методом коррекции эректильной дисфункции считают эндопротезирование полового члена.
К сожалению, у большинства мужчин в возрасте 65 лет и старше не происходит полное самостоятельное восстановление эректильной функции по сравнению с дооперационным уровнем, однако значительное количество пациентов адаптируются или применяют вышеуказанные средства для достижения удовлетворительного уровня половой активности.
Более молодые пациенты (40—60 лет) после выполнения нервосберегающей РПЭ значительно чаще способны к осуществлению полноценного полового акта без применения какой-либо дополнительной терапии. Талькотт и соавт. (1997) показали, что, несмотря на меньшую частоту эректильной дисфункции после выполнения нервосберегающей радикальной простатэктомией по сравнению с традиционной методикой, уровень неудовлетворённости сексуальной активностью у таких пациентов одинаков.
Практика показывает, что сексуальные нарушения доставляют пациентам значительно меньше неудобств, нежели расстройства мочеиспускания (диаграмма 4-4). Это можно объяснить пожилым возрастом пациентов, многие из которых не жили половой жизнью до операции, а отсутствие эрекции в послеоперационном периоде не влияет негативно на качество их жизни. По данным исследований, 75% пациентов удовлетворены или адаптировались к послеоперационным изменениям сексуальной функции, полноценную эрекцию отмечают только 12% больных. Этот факт необходимо учитывать при выборе метода лечения.

Диаграмма 4-4. Динамика отмечаемых пациентами сексуальных нарушений в течение 2 лет после радикальной простатэктомии
Неоадъювантная гормональная терапия и качество жизни
В настоящее время вопрос о необходимости проведения неоадъювантной гормональной терапии перед РПЭ пациентам с локализованным РПЖ остаётся открытым. Многочисленные исследования показали, что применение неоадъювантной гормонотерапии не увеличивает продолжительность жизни и существенно не снижает риск рецидива после операции. В то же время длительное её применение (более 6 мес) приводит к снижению качества жизни; ухудшению общего самочувствия, возникновению приливов, снижению либидо и сексуальной функции.
С другой стороны, применение агонистов гонадолиберина (трипторелин) коротким курсом до 3 мес позволяет существенно уменьшить объём предстательной железы, поскольку её значительные размеры усложняют проведение оперативного вмешательства. Кроме того, лечение трипторелином способствует уменьшению интраоперапионной кровопотери.
Важно отметить, что назначение трипторелина коротким курсом не вызывает существенного снижения либидо и половой функции, больные легко его переносят. Кроме того, применение трипторелина позволяет отсрочить операцию (без риска прогрессирования заболевания) и выбрать максимально удобное время для её проведения. Решение о назначении длительного курса принимают в индивидуальном порядке. Оно показано при высоком риске местного распространения опухоли.
Источник medbe.ru

Одним из видов радиотерапии, применяемым для максимально точного введения излучения в поражённую зону органа, является брахитерапия. Брахитерапия при раке простаты используется на начальных этапах заболевания и основывается на индивидуальном подходе к отдельному случаю.
Доброго вам здоровья, уважаемые читатели. Это Александр Бурусов, и в этой статье вы познакомитесь с таким методом терапии при раке простаты как брахитерапия, так же вы узнаете, какие осложнения она может вызывать.
Сразу отмечу, что при назначении этого метода лечения специалисты обращают внимание на возраст пациента, степень заболевания, а также возможность осложнений после лучевой терапии (классификация по степени риска). Важно, что такое лечение переносится гораздо легче, чем операции или дистанционные облучения.
Виды терапии
Брахитерапия при лечении рака предстательной железы (РПЖ) относится к радикальным методам лечения, но даже консервативно настроенные специалисты видят в нём эффективность и безопасность. Ведь главное преимущество заключается в том, что большая доза лучей направлена непосредственно на опухоль, а нежелательное воздействие на не поражённые органы и ткани сведено к минимуму.
Обязательное условие: объём простаты не должен превышать стандартных размеров, иначе вводимая игла не достигнет цели, а риск осложнений может повыситься. Уменьшить объём простаты возможно с помощью гормональной терапии, которая проводится в среднем в течение 5 месяцев. Только после уменьшения объёма железы возможно проведение брахитерапии.
Эффективность лечения рака предстательной железы зависит от своевременного выявления заболевания, поэтому необходимо регулярно проходит медицинские осмотры.
Процедура проведения
Первый этап брахитерапии заключается в планировании. Врач должен на основе показаний УЗИ, МРТ или КТ установить наиболее оптимальные параметры терапии. Сюда входят: дозировка облучения, количество вводимых в простату так называемых «зёрен» с радиоактивным йодом, а также точное место их введения.
После этого устанавливается метод лечения, их всего 2:
- низкодозная брахитерапия;
- высокодозная брахитерапия.
В первом случае лечение проводится с помощью введения в простату капсул. Длится такая терапия около 2 часов. Заранее очищается кишечник, а во время проведения пациент находится либо под полным наркозом, либо под неполным, который подразумевает обезболивание только нижней части тела.
Пациент располагается на спине в фиксированной позе с  согнутыми коленями, а в это время в полость раковой опухоли вводится ультразвуковой прибор для контроля изображения на мониторе.
согнутыми коленями, а в это время в полость раковой опухоли вводится ультразвуковой прибор для контроля изображения на мониторе.
После этого в простату вводятся «зёрна» через специальные иглы, которые затем вынимаются. Введённые капсулы при использовании постоянной брахитерапии остаются в организме на всю жизнь.
Затем начинается период облучения раковых клеток (в течение 2 месяцев), когда опухоль уменьшается в размерах, а затем совсем исчезает. В этот период не нужно постоянное наблюдение врача, а пациент может быть выписан из больницы в тот же день, как была проведена брахитерапия.
Во втором случае принцип действия тот же, но капсулы находятся в простате в течение 15 минут, а затем удаляются. Концентрация радиоактивности «зёрен» выше, чем при низкодозной брахитерапии, а значит оставлять капсулы на долгое время в организме пациента нельзя во избежание осложнений. Такая лучевая терапия проводится исходя из отмеченных специалистом индивидуальных особенностей случая заболевания.
Плюсы терапии
- малая продолжительность процедуры и восстановительного периода. Если терапия проведена без последующих осложнений, то пациент может заниматься привычной деятельностью уже в последующую неделю после проведения процедуры;
- высокая степень сохранения потенции;
- сведение травматичности к минимуму. После имплантации не наблюдается осложнений ректального характера, а также проблем с мочеиспусканием;
- хорошая переносимость пациентами. Брахитерапия отлично переносится людьми в возрасте, а также теми, кто параллельно болен другими заболеваниями;
- результативность. После применения данного вида лечения сохраняется оптимальное качество жизни пациента.
Возможные осложнения
После процедуры брахитерапии пациент может чувствовать необоснованную утомляемость, аллергические реакции на коже (зуд, покраснение), отмечается воспаление мочевого пузыря (цистит), кровь в моче, а также воспаление пищевого тракта. Возможна диарея, нарушение мочеиспускания, понижение эрекции.
Не исключено сужение мочевого канала, вероятны отёки ног, незначительное выпадение волос в паху. Эти последствия брахитерапии рака простаты могут проявлять себя по отдельности и в разное время, почти никогда в совокупности и одновременно.
Непосредственно после проведения операции в течение нескольких дней ранки от вводимых игл могут кровоточить, а в моче наблюдаться наличие кровяных сгустков. Такая реакция организма приемлема и не стоит бить тревогу.
Нужно употреблять больше жидкости, что бы произошло  самоочищение организма, а кровь вышла естественным путём. Ранки же можно обрабатывать антиаллергенными мазями с заживляющим эффектом, но они не приносят особого беспокойства и быстро проходят сами собой.
самоочищение организма, а кровь вышла естественным путём. Ранки же можно обрабатывать антиаллергенными мазями с заживляющим эффектом, но они не приносят особого беспокойства и быстро проходят сами собой.
Проблемы с мочеиспусканием, в частности недержание мочи, встречается крайне редко. Зато проблемы с эрекцией наблюдаются почти у 35% мужчин, что впоследствии может привести к полной импотенции. Не исключены трудности с опорожнением кишечника, может наблюдаться появление слизи в фекалиях.
Такие трудности с испражнениями обычно проходят через несколько недель без вмешательства специалистов или медикаментозного лечения. Не стоит бояться радиоактивности капсул, так как она имеет малый радиус действия на организм человека.
Не исключено, что после методов радикального лечения болезнь может вернуться, что является довольно частым явлением. По статистике биохимический рецидив рака простаты выявляется у одной трети больных РПЖ. Это зависит от этапа и расположения раковой опухоли, а также от показателя уровня простатического специфического антигена (ПСА), который не должен превышать 0,2 нг/мл.
Также в расчёт берётся история изменений и совокупность метастазов в лимфоузлах. Рецидивирование может образоваться как в самой простате, так и в прилегающих к ней тканях. Не исключено и поражение других органов, в первую очередь в группе риска находятся лёгкие и кости.
Вывод
Лечить рецидив нужно в соответствии с проводимой ранее терапией. Цель лечения заключается в устранении новообразования с последующим улучшением состояния пациента, избавлением от симптомов, нежелательных эффектов и избеганием летального исхода. В случае если пациент проходил лучевое лечение, повторное облучение поражённой опухолью зоны не рекомендуется.
Также развитие рецидивирующего рака может быть остановлено на несколько лет с помощью гормональной терапии. Главный минус такого лечения в том, что со временем раковая опухоль начинает расти, что говорит о гормонально-резистивной опухоли. Такая стадия рецидива неизлечима, а пациенты с наблюдаемыми осложнениями живут около года.
Возможно проведение химиотерапии, которая уменьшает интенсивность проявления симптомов, облегчая самочувствие пациента. На протяжении трёх лет отмечается стабилизация и улучшение общего состояния больного. Современными методами терапии рецидива являются криохирургическая и радиочастотная аблация, а также усовершенствованная система применения ультразвука.
Источник viva-man.ru
Аннотация научной статьи по медицине и здравоохранению, автор научной работы — В. А. Солодкий, А. Ю. Павлов, А. Д. Цыбульский
Исследования спасительной внутритканевой лучевой терапии при рецидивах рака предстательной железы были начаты в конце XX века. В последнее время все больше внимания уделяется брахитерапии высокой мощности дозы (high dose rate brachytherapy, HDR-BT) в качестве метода достижения локального контроля над опухолью. Цель исследования – первичный анализ лечения больных раком предстательной железы , которым была проведена спасительная HDR-BT по поводу подтвержденного локального рецидива после радиотерапевтических методов лечения. Предварительные результаты исследования говорят о возможности использования HDR-BT с достижением локального контроля над опухолью при низкой генитоуринарной и гастроинтерстициальной токсичности.
Похожие темы научных работ по медицине и здравоохранению , автор научной работы — В. А. Солодкий, А. Ю. Павлов, А. Д. Цыбульский,
Salvage high-dose-rate brachytherapy for local prostate cancer recurrence after radical radiotherapy
Studies salvage interstitial radiation therapy for recurrent prostate cancer, launched at the end of the XX century. In recent years, more and more attention is paid to high-dose-rate brachytherapy (HDR-BT) as a method of treating local recurrence. The purpose of research – preliminary clinical results of salvage high-dose-rate brachytherapy applied in cases of suspected local recurrence or of residual tumour after radiotherapy. Preliminary findings indicate the possibility of using HDR-BT, achieving local tumor control with low genitourinary toxicity.
Текст научной работы на тему «Спасительная брахитерапия высокой мощности дозы при местном рецидиве рака предстательной железы после радикальных радиотерапевтических методов лечения»
Спасительная брахитерапия высокой мощности дозы при местном рецидиве рака предстательной железы после радикальных радиотерапевтических методов лечения
В. А. Солодкий, А.Ю. Павлов, А. Д. Цыбульский
ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России; Россия, 117485Москва, ул. Профсоюзная, 86
Контакты: Алексей Дмитриевич Цыбульский vracheg@mail.ru
Исследования спасительной внутритканевой лучевой терапии при рецидивах рака предстательной железы были начаты в конце XX века. В последнее время все больше внимания уделяется брахитерапии высокой мощности дозы (high dose rate brachytherapy, HDR-BT) в качестве метода достижения локального контроля над опухолью.
Цель исследования — первичный анализ лечения больных раком предстательной железы, которым была проведена спасительная HDR-BTпо поводу подтвержденного локального рецидива после радиотерапевтических методов лечения.
Предварительные результаты исследования говорят о возможности использования HDR-BT с достижением локального контроля над опухолью при низкой генитоуринарной и гастроинтерстициальной токсичности.
Ключевые слова: рак предстательной железы, рецидив рака предстательной железы, сальважная брахитерапия, спасительная брахитерапия, высокодозная брахитерапия, высокомощностная брахитерапия, внутритканевая лучевая терапия, простатический специфический антиген
DOI: 10.17 650/1726-9776-2016-12-4-81-86
Salvage high-dose-rate brachytherapy for local prostate cancer recurrence after radical radiotherapy V.A. Solodkiy, A.Yu. Pavlov, A.D. Tsybul’skiy
Russian Scientific Center of Roentgenoradiology, Ministry of Health of Russia; 86 Profsoyuznaya St., Moscow 117997, Russia
Studies salvage interstitial radiation therapy for recurrent prostate cancer, launched at the end of the XX century. In recent years, more and more attention is paid to high-dose-rate brachytherapy (HDR-BT) as a method of treating local recurrence.
The purpose of research — preliminary clinical results of salvage high-dose-rate brachytherapy applied in cases of suspected local recurrence or of residual tumour after radiotherapy.
Preliminary findings indicate the possibility of using HDR-BT, achieving local tumor control with low genitourinary toxicity.
Key words: prostate cancer, prostate cancer recurrence, salvage brachytherapy, life-saving brachytherapy, high dose brachytherapy, high dose rate brachytherapy, interstitial radiation therapy, prostate-specific antigen
u i Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
В большинстве проведенных исследований в качестве внутритканевой лучевой терапии применяли низкомощностную брахитерапию на основе микроисточников 125I. Тем не менее в последнее время все большее внимание уделяется брахитерапии высокой мощности дозы (high dose rate brachytherapy, HDR-BT) в лечении локальных рецидивов РПЖ. B. Lee и соавт. сообщают о результатах лечения 21 пациента с местным рецидивом РПЖ после ДЛТ с использованием HDR-BT [11]. Хотя средний срок наблюдения был всего 19 мес, 2-летняя безрецидивная выживаемость составила 89 %. При этом не было отмечено токсичности III—IV степени со стороны желудочно-кишечного тракта, а генитоуринарные токсические реакции III степени были зарегистрированы в 14 % случаев. Y. Jo и соавт. опубликовали работу с результатами лечения 11 пациентов с использованием спасительной HDR-BT в режиме 2 фракций по 11 Гр с интервалом в б ч (суммарная очаговая доза 22 Гр ) [б]. В исследовании сообщается об отсутствии токсических реакций III—IV степени со стороны критических органов.
Цель исследования — первичный анализ лечения больных РПЖ, которым была проведена HDR-BT по поводу подтвержденного локального рецидива после радиотерапевтических методов лечения.
Материалы и методы
В РНЦРР с 2010 г. проводятся исследования по применению спасительной HDR-BT как альтернативы хирургическим методам лечения при рецидивах РПЖ после проведенных радиотерапевтических методов лечения. В данной работе мы оценивали предварительные клинические результаты спасительной
HDR-BT в случаях локального рецидива или остаточной опухоли после радиотерапевтических методов лечения.
Спасительную HDR-BT применяли для больных, отвечающих следующим критериям:
♦ проведение предварительного радиотерапевтического лечения без повторных хирургических вмешательств (радикальная простатэктомия, трансуретральная резекция предстательной железы);
♦ гистологически подтвержденный рецидив РПЖ;
♦ отсутствие регионарного и отдаленного ме-тастазирования, подтвержденного данными остеосцинтиграфии, магнитно -резонансной томографии (МРТ) органов малого таза с контрастированием, позитронно-эмисси-онной томографии, совмещенной с компьютерной томографией (ПЭТ-КТ), с использованием холина;
♦ отсутствие выраженной инфравезикальной обструкции по данным ультразвукового исследования (УЗИ) и урофлоуметрии в соответствии с Международной шкалой оценки простатических симптомов (International Prostatic Symptom Score, IPSS);
♦ согласие на проведение лечения в условиях РНЦРР методом HDR-BT с предварительным разъяснением возможных токсических реакций и ожидаемых результатов.
В период с 2011 по 2014 г. в РНЦРР спасительную HDR-BT по поводу подтвержденного локального рецидива РПЖ провели 9 больным в возрасте 59—77 лет (средний возраст 66 лет). Характеристика пациентов приведена в таблице.
В исследование вошли больные с рецидивом РПЖ различных групп риска прогрессирования (согласно классификации D’Amico): 4 больных после ДРТ, 2 — после сочетанной радиотерапии с применением источников 125I, 2 — после брахитерапии источниками 125I в монорежиме и 1 — после сочетанной радиотерапии с применением источника 192Ir. Инициальный уровень ПСА в группе колебался в пределах 8—80 нг/мл. Промежуток времени от проведенного лечения до появления рецидива составил 18—35 мес (в среднем 28 мес), время от выявления биохимического рецидива до спасительной HDR-BT — 5—10 мес. В этот период пациентам выполняли комплексную диагностику, направленную на обнаружение регионарного и отдаленного метастазирования. Кроме того, осуществляли оценку функционального состояния нижних мочевых путей. После верификации локального рецидива и проведения указанной диагностики всем пациентам выполняли андрогендепривационную терапию аналогами лютеинизирующего гормона рилизинг гормон (ЛГРГ) на протяжении 3 мес.
Характеристика пациентов, получивших спасительную HDR-BT по поводу локального рецидива рака предстательной железы Data on patients who received life-saving HDR-BT for !oca! recurrence ofprostate cancer
№ пациента Возраст пациента на момент спасительной HDR-BT, лет Стадия T Сумма баллов по шкале Глисона до Уровень ПСА ДО лечения, нг/мл Группа риска Метод радиотерапии Время до развития биохимического Сумма баллов по шкале Глисона ДО проведения HDR-BT Уровень ПСА ДО проведения Интервал между первичным и спасительным лечением, мес Резульг гат
гшсш s age ai the time of receiving life-saving HDR-BT, years Total Gleason score before treatment PSA level before treatment, ng/ml Risk group Radiation therapy method Time between primary and life-saving treatment, months
1 65 T3a 3 + 4 32 Высокая High ДРТ 70 Гр ЕВТ 70 Gy 28 3 + 3 4,0 38 Локальный контроль. ПСА-специфическая выживаемость 28 мес Local control. PSA-specific survival 28 months
2 60 T2b 4 + 5 23 Высокая High ДРТ 72 Гр ЕВТ 72 Gy 21 3 + 4 11,0 30 Локальный контроль. ПСА-специфическая выживаемость 12 мес Local control. PSA-specific survival 12 months
3 59 T3a 3 + 3 55 Высокая High ДРТ 74 Гр ЕВТ 74 Gy 18 3 + 3 7,2 26 Локальный контроль. Прогрессировать, метастазирование в скелет Local control. Progression, bone metastases
4 77 T2c 3 + 4 15 Средняя Intermediate ДРТ 78 Гр ЕВТ 78 Gy 30 4 + 3 8,3 39 Локальный контроль. Прогрессировать, метастазирование в скелет Local control. Progression, bone metastases
5 67 T2c 3 + 4 38 Высокая High TDR-BT1251 СОД 110 Гр + ДРТ 44 Гр LDR-BT 1251 TBD 110 Gy + ЕВТ 44 Gy 29 3 + 3 15,0 39 Локальный контроль. ПСА-специфическая выживаемость 32 мес Local control. PSA-specific survival 32 months
0НК0УР0Л0ГИЯ 4 2016 том 12 | CANCER UROLOGY 4 2016 vol. 12
ОНКОУРОЛОГИЯ 4 2016 том п | CANCER UROLOGY 4 2016 vol. 12
Окончание таблицы End of labte
№ пациента 1шнШ1 Возраст пациента на момент спасительной HDR-BT, лет Стадия T Сумма баллов по шкале Глисона до Уровень ПСА ДО лечения, Группа риска Метод радиотерапии Время до развития биохимического рецидива, мес Сумма баллов по шкале Глисона ДО проведения HDR-BT Уровень ПСА ДО проведения HDR-BT Интервал между первичным и спасительным лечени- Результат
Patient s age at the time of receiving life-saving HDR-BT, years Total Gleason score before treatment Risk group Radiation therapy method Kesuii
6 68 T3b 4 + 3 17 Высокая High LDR-BT 125I СОД 110 Lp + ДРТ 44 Lp LDR-BT 125I TBD 110 Gy + EBT 44 Gy 25 4 + 4 8,0 31 Локальный контроль. Прогрессирование, метастазирование в лимфатические узлы, скелет Local control. Progression, metastases in lymph nodes, bones
7 70 T2b 3 + 3 И Средняя Intermediate LDR-BT 125I СОД 145 Lp LDR-BT 125I TBD 145 Gy 34 4 + 4 5,2 40 Локальный контроль. ПСА-специфическая выживаемость 18 мес Local control. PSA-specific survival 18 months
8 72 T2b 3 + 3 8 Низкая Low LDR-BT 125I СОД 145 Lp LDR-BT 125I TBD 145 Gy 20 3+34 4,5 26 Локальный контроль. ПСА-специфическая выживаемость 10 мес Local control. PSA-specific survival 10 months
9 63 T3a 4 + 4 15 Высокая High HDR-BT 192Ir РОД 10 Lp + ДРТ 46 Lp HDR-BT 192Ir SBD 10 Gy + EBT 46 Gy 47 3 + 4 12,3 55 Локальный контроль. ПСА-специфическая выживаемость 12 мес Local control. PSA-specific survival 12 months
Примечание. HDR-BT — брахитерапия высокой мощности дозы; ПСА — простатический специфический антиген; ДРТ — дистанционная радиотерапия; LDR-BT — брахитерапия низкой мощности дозы; СОД— суммарная очаговая доза; РОД — разовая очаговая доза. У пациентов 3, 4 и 6 отмечено прогрессирование. Note. HDR-BT — high dose rale brachytherapy; PSA — prostate-specific antigen; EBT — externa! beam therapy; LDR-BT — tow dose rate brachytherapy; TBD — total boost dose; SBD — single boost dose. In patients 3, 4, and 6progression was obsetyed.
Все вмешательства проводили под спинно-мозго-вой анестезией на аппарате МюгоБеЬйгоп ЫБЯ с использованием трансректального ультразвукового датчика 4—9 МГц. Брахитерапию выполняли 3 фракциями в разовой очаговой дозе 9,5 Гр с 2-недельным перерывом между фракциями (суммарная очаговая доза 28,5 Гр). При этом значение линейно-квадратичной эквивалентной дозы при 2,0 Гр (ЬрББ2) за фракцию составило 89,6 Гр (при а/в = 1,5), процент предписанной дозы на орган-мишень (У100) — не менее 90,0 % (в среднем 95,2 %), процент объема органа-мишени, на который приходится 150 % предписанной дозы (У150), — менее 33,0 % (в среднем 19,7 %). Критическая доза на уретру и прямую кишку составили 110 и 70 % предписанной дозы соответственно. Для вычислений биологически эквивалентной дозы использовали линейно-квадратичную модель.
При проведении дозиметрического планирования сопоставляли данные МРТ, тансректального УЗИ и пункционной биопсии предстательной железы. Вычисляли зоны интереса с высокой степенью вероятности опухолевого роста. С учетом мультифокально-сти роста опухоли, присущей аденокарциноме предстательной железы, а также изменения суммы баллов по шкале Глисона при повторной биопсии зачастую в большую сторону мы считаем, что проведение фокального облучения приведет к заведомо худшему результату, при котором выполнение дальнейших видов спасительной терапии будет невозможно. В связи с этим в целевой объем облучения входили предстательная железа и базальные отделы семенных пузырьков. В целях протекции прямой кишки всем больным перед проведением брахитера-пии в парапростатическую клетчатку вводили объе-мообразующий гель, тем самым увеличивая расстояние между предстательной железой и прямой кишкой до 1,5—2,0 см.
Пациенты наблюдались через 1, 2, 3 мес после операции и в дальнейшем через каждые 3 мес. Контрольное обследование включало определение уровня ПСА, урофлоуметрию, лабораторные анализы крови и мочи, УЗИ предстательной железы и мочевого пузыря.
Динамика уровня ПСА. У 6 из 9 больных достигнут биохимический контроль опухоли. У 3 пациентов при динамическом наблюдении отмечали рост уровня ПСА после отмены андрогендепривационной терапии. По данным остеосцинтиграфии, МРТ органов малого таза с контрастированием, ПЭТ-КТ во всех случаях рецидива заболевания достигнут локальный контроль над опухолью. Однако у 2 больных выявлены отдаленные метастазы в костях скелета, у 1 — поражение групп подвздошных и парааортальных лимфати-
ческих узлов. Всем 3 пациентам продолжена андроген-депривационная терапия.
Токсические реакции. Ранние генитоуринарные токсические реакции были кратковременными. У всех больных в послеоперационном периоде развились дизурия, учащенное мочеиспускание вялой струей мочи, макрогематурия, которые купировались в первые 2—3 мес после окончания лечения и соответствуют II степени тяжести по категории RTOG (Radiation Therapy Oncology Group). У 1 больного (после сочетан-ной лучевой терапии с применением микроисточников 125I) отмечено развитие стриктуры мембранозного отдела уретры, что потребовало в последующем неоднократных эндоскопических вмешательств с применением лазерной абляции стриктуры, что, в свою очередь, привело к частичному недержанию мочи и переводу больного на аутокатетеризацию. В последующем у этого пациента отмечено прогрессирование заболевания в виде метастазирования в лимфатические узлы малого таза, парааортальные лимфатические узлы, кости скелета. У 1 больного (№ 9 в таблице) через 8 мес после лечения наблюдались инфекционно-воспалительные изменения мочевого пузыря с присоединением микрофлоры, что привело к выраженной дизурии, снижению объема мочевого пузыря. Пациенту проведена антибактериальная и противовоспалительная терапия с положительным эффектом.
Поздних токсических реакций со стороны прямой кишки не зарегистрировано в связи с применением объемообразующего геля, что позволило осуществить протекцию прямой кишки и существенно снизить объем ткани прямой кишки, попадающей в критические поля облучения.
Даже в случае, когда спасительная терапия по поводу рецидива РПЖ достигает благоприятных результатов, развитие токсических реакций III—IV степени тяжести со стороны смежных органов говорит о неэффективности проведенного лечения, поскольку назначение андрогендепривационной терапии является альтернативой для таких больных с сохранением качества жизни на высоком уровне.
В нашем исследовании в 6 из 9 случаев мы наблюдали биохимический контроль опухоли. Однако небольшое число больных и относительно короткий период наблюдения не дают окончательно интерпретировать полученные результаты лечения. По данным комплексной диагностики во всех 3 случаях прогрессирования удалось достичь локального контроля опухоли.
Выявление и определение факторов прогноза отдаленного метастазирования при рецидивах РПЖ, позволяющие определить пациентов, для которых действительно важна спасительная брахитерапия, являются очень важной задачей.
P.L. Nguyen и соавт., а также D.C. Beyer сообщили, что спасительная терапия эффективна в случае развития рецидивов после ДРТ, когда соблюдены следующие условия [12, 13]:
♦ низкая группа риска прогрессирования на начальной стадии лечения;
♦ биохимический рецидив наблюдается более чем через 1—2 года после основного лечения;
♦ уровень ПСА в момент спасительной терапии составляет i Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
3. Olarte A., Cambeiro M., Moreno-Jiménez M. et al. Dose escalation with external beam radiation therapy and high-dose-rate brachytherapy combined with long-term androgen deprivation therapy in high and very high risk prostate cancer: Comparison of two consecutive high-dose-rate schemes. Brachytherapy 2016;15(2):127-35.
DOI: 10.1016/j.brachy.2015.12.008. PMID: 26832677.
4. Garibaldi E., Gabriele D., Maggio A. et al. External beam radiotherapy with dose escalation in 1080 prostate cancer patients: definitive outcome and dose impact.
Panminerva Med 2016;58(2):121-9. PMID: 26785374.
5. Bolla M., Van Tienhoven G., Warde P., et al. External irradiation with or without long-term androgen suppression for prostate cancer with high metastatic risk: 10-year results
of an EORTC randomized study. Lancet Oncol 2010;11:1066-73.
6. Jo Y., Fujii T., Hara R. et al. Salvage highdose-rate brachytherapy for local prostate cancer recurrence after radiotherapy -preliminary results. BJU Int 2012;109(6):835-9. DOI: 10.1111/j.1464-410X.2011.10519.x. PMID: 21933327.
7. Matei D.V., Ferro M., Jereczek-Fossa B.A. et al. Salvage radical prostatectomy after external beam radiation therapy: a systematic review of current approaches. Urol Int 2015;94(4):373-82. DOI: 10.1159/000371893. PMID: 25765848.
8. Berlin A., Fernandez M.I. Avances en el tratamiento de cancer de prostata resistente a la castracion: enfasis en nuevas terapias hormonales. Rev Méd Chile 2015;(2):143-9.
9. Grado G.L., Collins J.M., Kriegshauser J.S. et al. Salvage brachytherapy for localized prostate cancer after radiotherapy failure. Urology 1999;53(1):2-10. PMID: 9886580.
10. Aaronson D.S., Yamasaki I., Gottschalk A. et al. Salvage permanent perineal radioactive-seed implantation for treating recurrence of localized prostate adenocarcinoma after external beam radiotherapy. BJU Int 2009;104(5):600-4. DOI: 10.1111/j.1464-410X.2009.08445.x. PMID: 19245439.
11. Lee B., Shinohara K., Weinberg V. et al. Feasibility of high-dose-rate brachytherapy salvage for local prostate cancer recurrence after radiotherapy: the University of California, San Francisco experience. Int J Radiat Oncol Biol Phys 2007;67(4):1106-12.
DOI: 10.1016/j.ijrobp.2006.10.012. PMID: 17197119.
12. Nguyen P.L., Chen R.C., Clark JA. et al. Patient-reported quality of life after salvage brachytherapy for radio-recurrent prostate cancer: a prospective Phase II study. Brachytherapy 2009;8(4):345-52.
DOI: 10.1016/j.brachy.2009.01.004. PMID: 19428311.
13. Beyer D.C. Brachytherapy for recurrent prostate cancer after radiation therapy. Semin Radiat Oncol 2003;13(2):158-65.
DOI: 10.1053/srao.2003.50015. PMID: 12728445.
Источник cyberleninka.ru